Fisika-Kimika»Fisika - Kimika
Materiaren egoera fisikoak
Egoera fisikoak
Materia hiru egoeratan aurki daiteke —egoera gotorrean (substantziak berezko forma eta bolumena duenean), isurkari edo likido egoeran (substantziak berezko bolumena izan arren, gordeta dagoen ontziaren forma hartzen duenean) eta gas egoeran (substantziak gordeta dagoen ontziaren forma eta bolumena hartzen duenean)—, eta gai asko eta asko hiru egoeretan aurkitzen da: gotor gehienak, adibidez, isurkari eta gero gas bilakatzen dira, berotzean; ura egoera gotorrean izotza da, eta gas egoeran lurrina. Gai gotorren edo solidoen ezaugarri aipagarrienak duten bolumena ia ez aldatzea (konstantetzat har daiteke) eta itxura batere ez aldatzea dira. Isurkariek ere bolumena apenas aldatzen duten, baina, aitzitik, ez dute itxura jakinik, gordeta dauden ontziaren-edo araberakoa baizik. Gai gotorrak eta isurkariak, beraz, konprimaezinak dira; ordea, bata ez da isurtzen eta bestea, berriz, jariakaria edo fluidoa da, gasak bezala. Gasek, berriz, ez dute ez forma ez bolumen jakinik, dauden lekuaren araberakoa baizik; jariakari konprimagarriak dira, beraz. Materiaren hiru egoerak, bestalde, orobat bereiz daitezke dentsitatearen arabera: gasek oso dentsitate txikia dute, isurkariek handiagoa, eta, salbuespenak salbuespen, gotorrek askoz ere handiagoa.

1 mol urek egoera fisiko ezberedinetan (solido, likido nahiz gas) betetzen duen bolumena

Taulako balioak ikusita, hau esan daiteke: gasetan molekulak oso barreiatuta daude, elkarrengandik aparte; isurkari eta gotorretan, aldiz, molekulen arteko tartea askoz txikiagoa da. Uraren kasuan,adibidez: ur isurkariaren mol batek 18 mililitroko bolumena hartzen du, baina ur lurrinaren mol batek, 100 °C eta 1 atmosferatan, 36 litro hartzen ditu. Gasetan, molekulak elkar eragiteko aukera gutxi izango lirateke (oso barrietatuta baitaude), haien abiadura handiagatik ez balitz. Giro tenperaturan gas egoeran diren sustantzia guztiak isurkari bihur daitezke haien tenperatura jaitsiz eta hartzen duten bolumena presioaren bidez txikituz (hots, konprimituz). Isurkari hegaskorrak —hau da, irakite puntu baxua dutenak— gas bihurtzen dira giro tenperaturatik hurbil. Horrela lorturiko gasei lurrin esaten zaie.
Baina, sustantzia bateko atomoak eta molekulak berdinak baldin badira (uraren kasuan, ),
zergatik ditu sustantzia horrek hain propietate desberdinak egoera batean eta bestean? Daltonek proposatu
zuen atomoaren teoria oinarri harturik, materiak egitura hau duela esan daiteke. Egoera gotorrean partikulak
(nahiz atomo, nahiz molekula, nahiz ioi) elkar ukitzen dutela daude, eta posizio finkoa dute. Gainera, gai
gotorren partikulak ordena geometrikoa jakin baten arabera antolatzen dira, kristal sareak eratuz.

Kuartzoa (a) silizearen (SiO2) era kristalinoa da, bere atomoak sare ordenatuan kokatzen dira. Silize funditua solido bihurtzen denean bere atomoak ordenarik gabe kokatzen dira espazioan (b).
Gotor amorfoek, berriz, —beirak eta polimero askok, adibidez— ez dute gordetzen geometria ordena hori.
Isurkariek ere elkar ukitzen dutela dituzte partikulak, ez baitira konprimitzen. Lehengo taulan ikus daitekeenez, isurkarien dentsitate balioak gotorrenen antzekoak dira —pixka bat txikiagoak—, baina isurkariak isurkorrak dira, geometria forma aldatzen dute, eta haien partikulek ez dute, gotorretan ez bezala, egongune jakin finkorik.
Gasetan, berriz, partikulak oso barreiatuta daude, elkarrengandik urrun. Hori dela eta, presioa handituz gero, erraz txikituko da haien bolumena. Gasetan partikula batetik bestera dagoen tartea partikula bera baino askoz ere handiagoa da, eta horregatik, presio eta tenperatura baldintza berdinetan, gasek partikula kopuruaren araberako bolumena hartzen dute (gogoan izan Avogadroren legea).
Egoeren arteko fase aldaketak
Ur piska bat ontzi batean utziz gero, denbora bitarte baten buruan, desagertu egingo da; hau da, ura lurrin bihurtu da. Gertaera horri lurrintzea esaten zaio, eta isurkariaren gainazalean gertatzen da. Ur kantitate bera ontzi itxi batean eta 20 °C-ko tenperaturan utziz gero, lurrintzearen eraginez ontzi barruko presioa 17,5 mm Hg-tan handitzen ikus daiteke. Presio horri uraren lurrin presioa esaten zaio (kasu honetan, 20 °C-tan duena, hain zuzen). Izan ere, isurkari edo likido baten lurrin presioa tenperaturaren araberakoa baita.
Ura eltze batean berotzen hasiz gero, lurrin presioa handituz joango da, eta gero eta ur kantitate handiagoa lurrinduko da. Halako batean, tenperatura jakin batean —100 °C-tan, hain zuzen, uraren kasuan— burbuilak sortuko dira eta isurkaria bor-bor hasiko da, gainezka egiten. Gertaera horri irakitea esaten zaio. Burbuila ur lurrinez osatua dago, eta osatu ahal izateko, haren presioak eta kanpoko presioak berdinak izan behar dute. Beraz, uraren lurrin presioa eta kanpoko egurats presioa berdintzen direnean, isurkaria irakiten hasten da. Isurkari baten, edozeinen, irakite puntua edo irakite tenperatura kanpoko presioaren arabera aldatzen da. Adibidez, uraren irakite puntua, egurats presio normalean (atmosfera bat edo 760 mm Hg), 100 °C-koa da, baina presioa 750 mm Hg-ra jaisten bada, urak 99,6 °C-tan irakiten du. Horrenbestez, kanpoko presioa atmosfera batekoa denean isurkariak duen irakite puntua da isurkariaren irakite puntu normala; beste era batera esanda, isurkari baten lurrin presioa 760 mm Hg-koa izateko behar den tenperatura da isurkari horren irakite puntu normala. Antzeko zerbait gertatzen da gai gotor edo solido bat isurkari bihurtzen denean (fusioa edo urtzea).

Solido bateko partikuletan gertatzen den bibraziozko higidura.
Atmosfera bateko presioan, helioa ez beste isurkari guztiak gotor bihur daitezke, tenperatura behar adina jaitsiz gero. Era berean, isurkari guztiak (batzuk beste batzuk baino errazago) gas bihur daitezke. Isurkari baten irakite puntua baxua denean isurkaria hegaskorra dela esten da. Isurkaria lurrintzean sortzen den gas horri lurrin esaten zaio, baina hala esatea, azken batean, ohitura bat besterik ez da, gas edo lurrin esatea, gauza bera baita. Egoera fisiko batetik beste batera aldatzen denean, sustantziak fase aldaketa izan duela esaten da.

Gerta daitezkeen fase aldaketa ezberdinak.
Gotor bat berotzen denean, haren partikulen energia zinetikoa handituz doa, eta partikula horiek oreka puntuaren inguruan egiten duten dardara areagotuz doa. Azkenean, gai gotorrak galdu egiten du bereizgarri duen antolaketa irmo hori, eta gai isurkarien antolaketa modua, aldakorra, hartzen du ordez.

Ezkerrean ura eta izotza dituen ontzi bat dugu eta eskuinean berriz bentzeno solido eta bentzeno likido dituena. Uraren kasuan hidrogenozko zubiak direla medio, izotzak dentsitate txikiagoa dauka ur likidoak baino eta horrexegatik izotza ez da hondoratuko. Bentzenoaren kasuan aldiz aurkako portaera daukagu (sustantzia gehienetan bezala).
Hala, gotorra urtu egin dela esaten da. Isurkaria gotortzea da horren aurkako prozesua. Urtze prozesua endotermikoa da, eta gotortzea, berriz, exotermikoa.

Likido bateko partikulen mugimenduaren ondorioz, likidotik zenbait partikulak gas egoerara ihes egingo du.
Isurkaria berotzean energia ematen zaie hura osatzen duten partikulei, eta energia partikula horien artean banatzean, gainerako partikulekin lotzen dituzten molekula arteko indarrak hausteko eta isurkaritik alde egiteko adina energia metatuko dute batzuek. Energia handieneko partikulek alde egiten duten neurrian, geratzen direnen batez bestekoa txikiagoa izango da eta tenperaturak behera egingo du. Fenomeno horri esker hozten zaigu larruazala kolonia, alkohola edo beste isurkari hegaskorren bat gainean botatzen dugunean.
Gasak
Sustantzia kimiko asko eta asko gas egoeran aurkitzen dira izadian.
Inguratzen gaituen atmosfera edo eguratsa bera ere gas nahaste bat da, besteak beste, eta batez ere, oxigenoa
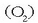 eta nitrogenoa
eta nitrogenoa
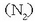 dituena.
dituena.
XVII. mendetik aurrera zientzilariak gasen portaera esplikatzen saiatu ziren, esperimentuetan oinarriturik. Eta ondorio hauek atera zituzten:
- Gasen bolumena erraz txiki daiteke presioa handituz.
- Gas batek inguruan duen bolumen osoa beteko du.
- Gasak elkarrekin nahasten dira. Beraz, gas bat baino gehiago ontzi batean sartzen direnean, nahasten dira eta homogeneotasunez banatzen dira ontzian zehar. Alderantzizko prozesua,hots, gas nahaste bateko osagaiak banatzea, ez da erraz gertatzen.
– Gasen propietateak zehazteko haien tenperatura, presioa, bolumena eta kantitatea zehaztu behar dira.
Gasen legeak
Boyleren legea: 1662an Robert Boylek lege batzuetan bildu zituen gasekin egin zituen esperientziak. Tenperatura aldatu gabe, gas batek betetzen duen bolumena eta aplikatutako presioa alderantziz proportzionalak dira. Hori honela adierazten da:

Honela dio Boyleren legeak: tenperatura jakin batean, gas ideal baten bolumenaren eta presioaren arteko biderkadura berdina da beti. Gaur egun jakina da gas guztiek ez dutela Boyleren legea zehatz-mehatz betetzen, baina, giro tenperaturan eta egurats presioan, baliagarria da gas gehienentzat.
Charles eta Gay-Lussacen legea: 1800 urte inguruan Charles eta Gay-Lussac zientzilariek tenperatura handitzean gasek duten hedatzea aztertzen hasi ziren. Haien iker lanaren arabera, presio berdina denean gas ideal batean, tenperatura handitzen den neurri berean handitzen da haren bolumena. Gasaren tenperatura gradu batean handitzean haren bolumenaren aldaketa bolumenaren 1/273 zen. Ondoko irudian ikus daitekeenez, tenperaturaren aurrean bolumena irudikatzean lerro zuzen bat agertzen da. Tenperatura jaistean bolumena ere txikitu egiten da, baina tenperatura berean gasa isurkari bihurtuko da (lerro zuzena ebakita dago). Zuzen hori estrapolazioz V = 0 lerroraino eramanez gero, tenperaturaren balio berezi hau lortzen da: -273 °C. Irudiaren arabera, tenperatura horretan gasaren bolumenak zero izan behar luke. William Thomson Kelvin fisikari britaniarrak, hainbat gasetan estrapolazioa eginez, beti puntu bera lortzen zela ikusi zuen. Tenperatura horri (-273.15 °C) zero absolutua deitu zion, eta hala, eskala berriari Kelvin eskala esaten zaio, zientzilariaren ohorez. Celsius eskalako zeroa (0 °C) Kelvin eskalako 273 graduren (273 K) baliokidea da. Beraz, tenperatura Kelvinetan emateko, Celsius graduei 273 gradu gehitu behar zaizkie. K = °C + 273.
Tenperatura Kelvin graduetan emanez gero, honela adierazten da Charles eta Gay-Lussacen legea:
V = k T (presioa eta gas kantitatea aldatu gabe)
— Gas idealaren legea: orain arte azaldu ditugun legeak elkarrekin konbinatuz beste ekuazio matematiko bat lor daiteke. Gas guztiek ez dituzte zehatz-mehatz lege horiek betetzen; desbideratze txikiak gerta daitezke. Proposatzen diren legeak eta ekuazioak zehaztasunez beteko lituzkeen gasari gas ideala esaten zaio. Gasen portaera, labur zurrean, honela adieraz daiteke:


Beraz, PV = k’’’nT bete egingo da eta proportzioa gordetzeari dagokion adierazpen hori ekuazio egoki bihur daiteke k’’’ konstantearen balioa zehaztuz gero:
PV = nRT, adierazpena lor daiteke
R konstantearen balioa erabiltzen den unitatearen araberakoa izango da. Presioa atmosferatan, bolumena litrotan eta tenperatura kelvin gradutan erabiliz gero, R konstantearen balioa 0.082 atm.l/mol.K izango da. R konstanteari gasen konstante unibertsala esaten zaio.
— Daltonen legea: John Dalton 1807an aire siku eta hezea aztertzen ari zela bere izena daraman legea proposatu zuen. Gasen nahaste bat dugunean nahaste osoak eragindako presioa bere osagaien presio partzialen batura izango da. Eta zer da baina presio partziala? Gas horrek tenperatura horretan eta bolumen osoan bera bakarrik balego beteko lukeen presioa.

Materiaren teoria zinetiko molekularra
1738. urtearen inguruan Bernoullik gasen molekulak etengabe mugitzen ari zirela proposatu zuen, eta etengabeko higidura hori zela eta, molekulek talka egiten zutela ontziaren pareten kontra, presioa eraginez. 1857an Clausiusek beste teoria bat proposatu zuen lege esperimentalak (Boyleren legea, Charles eta Gay-Lussacena, eta Avogadrorena, hain zuzen ere) azaldu nahian. Hona hemen teoria horren hipotesi nagusiak:
– Gasen molekulak urrun samar daude elkarrengandik eta molekulen artean ez dago indar sendorik.
– Gas baten molekulak etengabe ari dira mugitzen lerro zuzenean eta edozein norabidetan, baina bakoitza bere abiadurarekin. Molekulen arteko talkak eta molekulen eta pareten artekoak talka elastikoak dira (ez dago energia galerarik).
– Tenperatura berean aurkitzen diren gasen energia zinetiko totala berdina da.
Energia zinetikoa tenperaturari buruz zuzenki proportzionala da.
Energia zinetikoak  itxura duenez
(m = masa; v = abiadura), masa handiko gasetan batez besteko abiadura txikiagoa izango da, eta alderantziz.
Horregatik gas arinen molekulak (adidibidez, hidrogenoa edo helioa) bizkorrago mugitzen dira gas astunenak
baino (anhidrido karbonikoa), biak tenperatura berean izanik ere.
itxura duenez
(m = masa; v = abiadura), masa handiko gasetan batez besteko abiadura txikiagoa izango da, eta alderantziz.
Horregatik gas arinen molekulak (adidibidez, hidrogenoa edo helioa) bizkorrago mugitzen dira gas astunenak
baino (anhidrido karbonikoa), biak tenperatura berean izanik ere.
Teoria horren ondorio nagusia lege esperimentalak azaltzeko balio izatea da.
Boyle eta Daltonen legeak: gas batek ontziaren paretetan egiten duen presioa gas horren partikulek pareten aurka dituzten talken ondorio izango da. Beraz, presioan bi faktore nagusi bereiz daitezke: denbora unitate jakin batean zenbat partikulek egiten duten talka pareten aurka, eta talka horien indarra. Zer gertatuko da ontziaren bolumena lehengoaren erdia bada? Bolumen txikiagoan molekula kopuru bera dagoenez, denbora unitate bakoitzeko talka kopurua handitu egingo da, eta presioa ere bai.
Charles eta Gay-Lussacen legea: energia zinetikoa tenperaturari buruz zuzenki proportzionala denez, gas lagin baten tenperatura bikoiztean bere molekulen energia zinetiko totala bikoiztu egingo da, eta presioari aldatu gabe eutsiz gero, talken indarrak bolumena bikoiztuko du. Gauza bera, baina alderantziz, gertatuko litzateke tenperatura erdira jaistean.
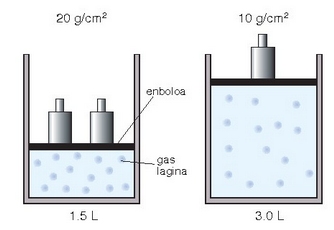
Presioa handitzerakoan gasaren bolumenak behera egingo du.
Eta nola azal daiteke, teoria horren arabera, egoera fisiko desberdinak eta fase aldaketak izatea?
Gasetan molekulak etengabe higitzen ari dira eta elkarren artean eta pareten aurka dituzten talkak gasaren presioaren eragile izango dira. Tenperatura handitzean energia zinetikoa handituko denez, molekulen batez besteko abiadura handitu egingo da. Batez besteko balioez hitz egin behar da, molekula guztiek ez baitute abiadura berdina. Molekulen artean abiaduren banaketa dago.
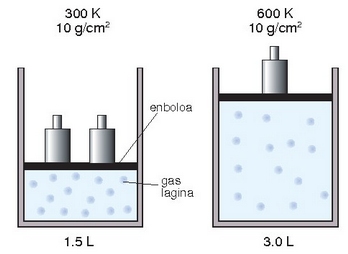
Presioa aldatu gabe tenperatura bikoizterakoan bolumena ere bikoiztu egingo da
Tenperatura eta energia zinetikoaren artean dagoen erlazio zuzena dela-eta, tenperatura 0 K denean energia zinetiko totala 0 izango da, hots, gasaren molekula guztiak geldirik egongo dira. Horregatik esaten zaio tenperatura horri 0 absolutua, ezinezkoa baita tenperatura hori baino baxuagoa izatea.

Gas baten molekulen abiaduren banaketa tenperatura ezberdinetan.
Gai gotor edo solidoetan, aldiz, partikulen higitzeko ahalmena askoz ere txikiagoa da, ia desagertu egin da. Molekulak egongune finko batzuen inguruan ari dira dardaratzen, haien energia termikoa molekulen arteko indarra baino txikiagoa baita.

Solido bateko partikuletan gertatzen den bibraziozko higidura.
Gai trinkoa berotzean areagotu egiten da dardarazko higidura (partikulek energia zinetiko handiagoa baitute), eta molekulen arteko indarra baino handiagoa denean higidura, ordena geometrikoa hautsi egiten da eta gaia isurkari bihurtzen.
Isurkarietan, berriz, partikulek higitzeko aukera gehiago dute. Energia molekulen artean banatzen denez, beti izango dira energia handiko (hots, abiadura handiko) partikulak; horiek eragin dezakete lurrinketa isurkariaren partikulak handik ihes egitean.
Hala beraz, isurkarian gelditzen diren molekulen batez besteko energia txikiagoa izango da, eta isurkariaren tenperatura jaitsi egingo da.

Likido baten molekulek nola egiten duten ihes lurrunera.
Prozesuak aurrera jarrai dezan, isurkariak ingurunetik hartuko du behar duen beroa, eta horregatik, alkoholaz bustitzen garenean, freskatu egiten gara. Ontzia itxita baldin badago, lurrintzea gertatzen denean gas molekulen kontzentrazioa handituz joango da ontzi barnean. Kantitate hori behar hainbat handia denean, denbora unitate batean isurkarira itzultzen den molekula kopurua eta handik ihes egiten dutenena berdindu egingo dira, eta sistemak oreka lortu duela esango da. Une horretan ontzian dagoen presioa isurkariaren lurrin presioa izango da tenperatura horretan.
Lurrintzea gerta dadin molekulen arteko indarrak apurtu egin behar dira, eta, honenbestez, hori gertatzeko behar den energia (lurrintze beroa edo lurrintze entalpia) molekulen arteko indarren neurri bat izango da.
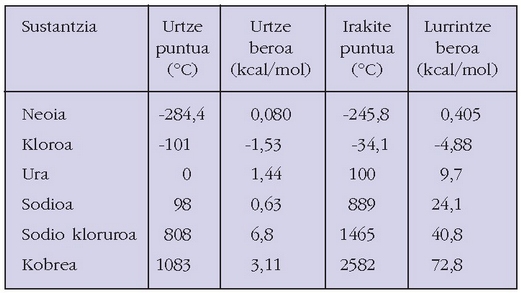
Taula horren aurrean zera esan daiteke: kasu guztietan lurrintze entalpia handiagoa da urtze entalpia baino: urtzeko molekulen arteko indarrak ahuldu egin behar baitira, eta lurrintzeko, aldiz, apurtu. Bestalde, molekulen arteko indarrak ahulak baldin badira, tenperatura baxua aski da gotorra urtzeko edo isurkaria lurrintzeko; hala, gai horiek urtze eta irakite puntu baxuak dituztela esango da. Molekulen arteko indarrak handitu ahala urtze eta irakite puntuak handitu egiten dira.
Presioa neurtzen
Gainalde unitateko ari den indarraren neurria da presioa, eta unitate desberdinetan adieraz daiteke: atmosferatan (atm), merkuriozko milimetrotan (mm Hg), torr-etan, pascaletan (Pascal). Presioa neurtzeko tresnen artean ezagunena barometroa litzateke beharbada. Merkurioz beteriko hodi bat da (800 mm luzea, gutxi gorabehera), mutur batean itxia eta merkurioz beteriko ontzi baten gainean buruz behera jarria, airea sartzen utzi gabe. Hodiko merkurioa hodian behera jaitsiko da leku jakin batean geratu arte. Hodiko merkurioak eta eguratsak ontziko merkurioaren gainean presio berbera egiten dutelako geratu da merkurioa leku horretan. Presioa neurtzeko, hodian geratzen den merkurioak adierazten duen maila erabiltzen da. Merkuriozko barometroak sinpleak eta ezagunak direnez, ohitura handia dago presioa merkurio mm-tan adierazteko. Evangelista Torricelli (1608-1647) matematikari eta fisikari italiarrak asmatu zuen barometroa.

Barometroa: egurats-presioa merkurioaren zutabearen altuera izango da: mm Hg.
Manometroa, berriz, U itxurako hodi bat da. Hodiaren adar bat eguratsera zabalik dago, eta presioa neurtu nahi den ontzira lotzen da bestea. Hodiaren barnean merkurioa dago (izan daiteke beste isurkari bat ere). Atmosfera presioa gehi (edo ken) merkuriozko bi mailen arteko aldeak ( h) eragindakoa izango da ontziko gasak eragiten duen presioa.

Manometroa
Atmosfera presioa ere aldakorra da, ordea; eguratsaren baldintzek eta itsas mailarekiko goratasunak eragiten baitiote. Itsas mailatik urrundu ahala presioa txikiagoa da. Itsas mailan eta 45°-ko luzeran, 0 °Ctan, merkurioaren mailak 760 mm adierazten ditu; presio horri atmosfera bateko presioa esaten zaio: 1 atm = 760 mm Hg = 760 torr = 1,023 bar. Nazioarteko banako edo unitate sisteman (SI) presio unitateak pascaletan adierazten da: 1 atm = 1,013 105 Pa = 101,3 kPa.




