Fisika-Kimika»Fisika - Kimika
Protoi transferentziazko erreakzioak
Arrheniusen azido eta baseen teoria
Azidoen ur disoluzioen propietate bereizgarria, Arrheniusek 1887an atera zituen ondorioen arabera,
disoluzioetan hidrogeno ioiak egotea da. Baseen tasunak, berriz, disoluzioetan dauden
 ioiek emanak direla aurkitu zuen. Aurkikuntza horietan oinarrituta, ondoko definizioa proposatu zuen azido eta baseentzat:
ioiek emanak direla aurkitu zuen. Aurkikuntza horietan oinarrituta, ondoko definizioa proposatu zuen azido eta baseentzat:
Ur disoluzioetan:
Azidoa uretan disolbatutakoan hidrogeno ioiak  emanez disoziatzen edo banatzen den substantzia da.
emanez disoziatzen edo banatzen den substantzia da.
Basea, berriz, uretan disolbatzerakoan hidroxilo ioiak
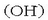 ematen dituen substantzia da.
ematen dituen substantzia da.
Definizio hau betetzen dituzten azidoen adibide gisa azido klasiko guztiak har daitezke:
 , etab.
Azido klorhidrikoa, esaterako, honela disoziatzen da:
, etab.
Azido klorhidrikoa, esaterako, honela disoziatzen da:
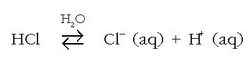
Protoiak berez ez dira egonkorrak ur soluzioetan, eta beren berezko egoera eta egoera egonkorra disolbatuta egotea da,
hidroxonio edo oxonio ioiak 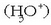 emanez.
emanez.
Baseak metalen hidroxidoak dira, batez ere metal alkalino eta alkalino lurtarren hidroxidoak. Hauek ere, uretan disolbatzerakoan, hidroxilo ioiak ematen dituzte:
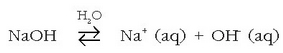
Arrheniusen teoriari jarraituz erraz ulertzen da azidoek eta baseek elkarrekin erreakzionatu eta neutralizatzeko duten ahalmena.
Disoluzioetan uraren bi ioiak agertzen direnez  honelakoren bat izango litzateke neutralizazio erreakzioa, beti ere Arrheniusen teoriaren arabera:
honelakoren bat izango litzateke neutralizazio erreakzioa, beti ere Arrheniusen teoriaren arabera:

Beste ioiak,  eta
eta  adibidez, azido klorhidrikoa eta sodio hidroxidoa
disolbatzen badira, batere aldatu gabe geratzen dira disoluzioan.
adibidez, azido klorhidrikoa eta sodio hidroxidoa
disolbatzen badira, batere aldatu gabe geratzen dira disoluzioan.
Bronsted eta Lowryren teoria
Aurrerapen handia ekarri zuen Arrheniusen teoriak, baina aurki
gelditu ziren agerian teoria honen eragozpenak. Nola izan zitekeen,
adibidez, OH-rik ez zuten substantziak basikoak izatea? Amoniakoa
 eta sodio karbonatoa
eta sodio karbonatoa
 , bi adibide aipatzeagatik,
baseak dira ur disoluzioetan eta ez dute, Arrheniusek esaten zuenaren aurka, hidroxilo ioirik. Arrheniusek finkaturiko azido-base
kontzeptua, beraz, ez ziren guztiz zuzenak, eta horrenbestez, beste teoria bat asmatu zuten Bronsted eta Lowryk.
, bi adibide aipatzeagatik,
baseak dira ur disoluzioetan eta ez dute, Arrheniusek esaten zuenaren aurka, hidroxilo ioirik. Arrheniusek finkaturiko azido-base
kontzeptua, beraz, ez ziren guztiz zuzenak, eta horrenbestez, beste teoria bat asmatu zuten Bronsted eta Lowryk.
Hidrogeno ioia ez da egonkorra ur disoluzioetan, eta hidronio ioia
 ematen du egoera horretan.
Hidronio ioia urak sortua izan daiteke, ur molekulak protoi bat
ematen du egoera horretan.
Hidronio ioia urak sortua izan daiteke, ur molekulak protoi bat
 hartzen badu.
Arrheniusen teoriaren arabera azidoak protoiak askatzen dituzten substantziak direnez, Bronsted eta Lowryren teoriaren
arabera beste substantzia bati protoiak ematen dizkion substantzia izango litzateke azidoa, eta basea, berriz, protoiak
hartzen dituen substantzia. Azido klorhidrikoak, uretan disolbatzerakoan, hidronio ioiak
hartzen badu.
Arrheniusen teoriaren arabera azidoak protoiak askatzen dituzten substantziak direnez, Bronsted eta Lowryren teoriaren
arabera beste substantzia bati protoiak ematen dizkion substantzia izango litzateke azidoa, eta basea, berriz, protoiak
hartzen dituen substantzia. Azido klorhidrikoak, uretan disolbatzerakoan, hidronio ioiak
 ematen baditu, honela idatz daiteke erreakzioa:
ematen baditu, honela idatz daiteke erreakzioa:

Erreakzio honetan disolbatzaileak hartzen du parte eta horrek esan nahi du disolbatzaileak baduela
zerikusirik gaien azidotasunean eta basikotasunean. Bronsted eta Lowyren teorian HCl azidoa da, protoia
askatzen duelako, Cl - ere emanez.  berriz, basea izango litzateke,
berriz, basea izango litzateke,  emanaz, protoia hartzen duelako.
emanaz, protoia hartzen duelako.
Horiek kontuan izanda, eta azido eta base kontzeptuak protoi transferentziarekin lotuz,
erraz ulertzen da, adibidez, amoniakoa zergatik den basikoa uretan


Amoniakoa basikoa da protoia hartu duelako. Ura, berriz, azidoa da amoniakoaren aurrean protoia askatu duelako. Azido klorhidrikoaren eta amoniakoaren adibideak harturik, ura batean basea dela ikus daiteke eta bestean azidoa. Hau izango litzateke teoria berriaren beste aurrerakuntza bat, alegia substantzia bat ez da azidoa edo basea berez, zeinekin jartzen dugun halakoa baizik.
Azido-base erreakzioak protoi transferentziazko erreakzio itzulgarriak dira.
Hori dela eta, azido klorhidrikoaren erreakzioan hidronio ioia
 azidoa
izango litzateke protoia ematen diolako
azidoa
izango litzateke protoia ematen diolako  -ari (basea).
Bigarren erreakzioan, berriz, OH - ioia basea da,
-ari (basea).
Bigarren erreakzioan, berriz, OH - ioia basea da,  amonio ioiak
amonio ioiak 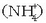 askatutako protoia bereganatzen duelako.
askatutako protoia bereganatzen duelako.
Orokorrean honela idatz daiteke azido-base erreakzioa:

Azido-base erreakzio baten ondorioz beste azido bat eta beste base
bat eratzen dira. Erreakzioan sorturiko azido eta basearen artean
protoi bateko aldea duten gaiek azido-base pare konjugatua eratzen dute.
 -gaiek azido-base pare konjugatua eratzen dute.
Eta beste horrenbeste
-gaiek azido-base pare konjugatua eratzen dute.
Eta beste horrenbeste  pareak.
pareak.
HCl azidoaren base konjugatua  da eta,
alderantziz,
da eta,
alderantziz,  -aren azido konjugatua HCl da.
-aren azido konjugatua HCl da.
 -aren azido konjugatua, berriz,
-aren azido konjugatua, berriz,
 da eta alderantziz.
da eta alderantziz.
 parea azido-base pare konjugatu
bat da eta
parea azido-base pare konjugatu
bat da eta  parea beste azido-base pare konjugatu bat.
parea beste azido-base pare konjugatu bat.
Azido-base erreakzioak itzulgarriak dira, baina alde batera ala bestera egongo dira alderatuta, zein azido eta base elkartzen diren.
Azidoaren eta basearen kontzeptua erlatiboa da, lehen esan den bezala; HCl-arekin esaterako, ura basea da, baina azido gisa jokatzen du
 -aren aurrean.
Gertaera hau orokorra da gai guztientzat, baina sarriagoa da erlatibotasun hori substanzia jakin batzuetan;
gai hauei anfotero edo anfolito esaten zaie.
-aren aurrean.
Gertaera hau orokorra da gai guztientzat, baina sarriagoa da erlatibotasun hori substanzia jakin batzuetan;
gai hauei anfotero edo anfolito esaten zaie.
Bronsted eta Lowryren teoria orokorragoa da Arrheniusen teoria baino. Hala ere, azido kontzeptuari dagokionez ez dago alde
handirik bien artean; bien arabera, substanzia batek, azidoa izan dadin, protoiak behar ditu (bat gutxienez).
Hau da, Arrheniusen teoriako azido guztiak azidoak dira Bronsted eta Lowryrenean ere.
Baina hauen arabera, gai gehiago ere badira azidoen sailean, Arrheniusen teorian zenbait ioi ez baitziren azidotzat hartuak:
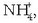 ,
,
 etab.
etab.
Bi teorien arteko desberdintasun nagusiak basearen kontzeptuari dagozkio. Hasteko, metalen hidroxidoak
 etab.-,
Arrheniusen base tipikoak, baseak dira Bronsted eta Lowryren teorian, baina uretan disolbatzerakoan OH - ioiak ematen dituztelako,
izan ere, hauek dira teoria honetan base eran jokatzen dutenak.
etab.-,
Arrheniusen base tipikoak, baseak dira Bronsted eta Lowryren teorian, baina uretan disolbatzerakoan OH - ioiak ematen dituztelako,
izan ere, hauek dira teoria honetan base eran jokatzen dutenak.
Bestalde, azido-base kontzeptuak definitzeko protoiak askatzeko edo bereganatzeko joera kontuan
harturik, askoz ere substanzia gehiago sar daitezke baseen sailean; bigarren teorian gaiek ez dute OH -
-rik eduki behar base izateko, protoiak eskuratzeko gaitasuna izatea aski dute. Zenbait gairen basikotasuna oso zaila zen azaltzen Arrheniusen teorian:
 (amoniakoa),
(amoniakoa),
 (metil amina),
(metil amina),
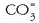 (karbonatoa),
(karbonatoa),
 (sulfuroa),
HCO–3 (hidrogenokarbonatoa edo
bikarbonatoa), etab
(sulfuroa),
HCO–3 (hidrogenokarbonatoa edo
bikarbonatoa), etab
Gilbert Newton Lewis (1875-1946)
Massachusettsen jaio zen, baina 1884an haren familiak Lincolnen (Nebraska) hartu zuen bizilekua. Unibertsitate ikasketak Nebraskako unibertsitatean hasi zituen, baina gero Harvardera joan zen, eta unibertsitate horretan bertan egin zuen doktoretza 1899an. Bolada batez Alemanian egon zen ikasketak sakontzen, eta 1905ean Massachusettseko Teknologia Institutuan (MIT) hasi zen lanean. 1912an Berkeleyko (Kalifornia) unibertsitateko irakasle izendatu zuten. Haren zuzendaritzapean, Berkeleyko kimika sailak ospe handia iritsi zuen nazioartean.
Sormen handia eta jakin-nahi handia zuen, eta horri esker garrantzi handiko ekarriak egin zituen kimikaren zenbait alorretan. Lewis izan zen atomoen arteko lotura elektroi pare berak izateak sortzen zuela lehenengo proposatu zuena, eta ideia horri jarraiturik egituren sinbolismoa sortu zuen, elektroiak puntuen bidez adierazten dituena (Lewisen egiturak). Ekarri handiak egin zizkion termodinamikari (energia aldaketei, alegia), eta termodinamikaren irakaskuntzan eragin handia izan zuen testu liburu bat idatzi zuen beste zientzialari batzuekin elkarlanean. Azidoen eta baseen definizio berri bat proposatu zuen, eta hura izan zen ur astuna egoera garbian prestatu eta aztertu zuen lehena:
Azidoen eta baseen indar erlatiboa
Azido klorhidrikoa azido sendoa dela edo azido azetikoa azido ahula dela esan ohi da sarritan. Sosa kaustikoa (sodio hidroxidoa), baseen artean, base sendoa da, eta amoniakoa base ahula. Azidoen eta baseen sendotasunak ez du zerikusirik protoiak askatzeko edo hartzeko duten gaitasunarekin.
Arrheniusen teorian azido bat sendoa da uretan disolbatutakoan guztiz disoziatzen bada. Ahula izango da, ostera, erabat disoziatzen ez bada.
Bronsted eta Lowryren teorian antzera esan daiteke, azido bat sendoa izango da protoia askatzeko joera duenean; basea, berriz, sendoa izango da protoia hartzeko joera duenean. Baina, gorago esan den bezala, protoiak askatzeko edo hartzeko joera hori erlatiboa da, ez baita gauza bera protoiak askatzeko gaitasun handia duen gai bat protoiak hartzeko gaitasun handia duen gai batekin elkartzea ala protoiak askatzeko gaitasun handia duen beste gai batekin elkartzea. Substantzia bera izan arren, lehenengo kasuan erraztasun handiagoa izango du protoia askatzeko bigarrenean baino.
Azido bat sendoa bada (erraztasuna du protoia askatzeko) bere base konjugatua oso base ahula izango da, zail egingo zaiolako protoia hartzea. Azido bat, ostera, ahula bada, dagokion base konjugatuak erraztasun handia edukiko du protoia hartzeko eta base konjugatua sendoa dela esango da. Orokorrean, zenbat eta sendoagoa izan azidoa, orduan eta ahulagoa izango da dagokion base konjugatua, eta alderantziz.
Azido baten indarra (edo base batena), azido horrek parte hartzen duen erreakzioaren oreka-konstantearen bidez adieraz daiteke. Oro har, HA bada azidoa, ondoko erreakzioaren oreka-konstantea kalkulatuko dugu:

Normalean azidoen eta baseen indarra urarekin alderatuz neurtzen da. Horrela, goiko erreakzioaren oreka-konstantea lortzeko:

Disoluzio diluituetan, hauek baitira normalean laboratorioan erabiltzen direnak, uraren kontzentrazioa konstantea, gutxi gorabehera, eta ur garbiaren kontzentrazioaren berdina da. Hori dela eta, oreka-konstantearen barruan sartu ohi da, eta honelaxe adierazten da horrelako erreakzioentzat oreka-konstantea:

 azidoaren disoziazio-konstante
edo ioitze-konstantea da, eta HA azidoaren sendotasuna neurtzen du. Zenbat eta handiagoa izan bere balioa, orduan eta sendoagoa
izango da azidoa eta ahulagoa haren base konjugatua.
azidoaren disoziazio-konstante
edo ioitze-konstantea da, eta HA azidoaren sendotasuna neurtzen du. Zenbat eta handiagoa izan bere balioa, orduan eta sendoagoa
izango da azidoa eta ahulagoa haren base konjugatua.
Antzera azal daiteke base baten basikotasuna. B bada orokorrean basea, urarekin erreakzionatzean hauxe aterako da:

Konstante hau basearen disoziazio edo ioitze-konstantea da eta basearen indar erlatiboa ematen du urarekiko.
Indarra beti uraren arabera neurtzen denez, zilegi da azidoak eta baseak bere indarraren arabera sailkatzea.

Ur soluzioetan azido guztiek, izan ahulak nahiz sendoak, ematen dituzte
 ioiak;
beraz, ur disoluzioetan egon daitekeen azidorik sendoena berau (hidronio ioia) da. Hori baino azido sendoagoak
guztiz disoziatuta egongo dira ur disoluzioetan eta beren
ioiak;
beraz, ur disoluzioetan egon daitekeen azidorik sendoena berau (hidronio ioia) da. Hori baino azido sendoagoak
guztiz disoziatuta egongo dira ur disoluzioetan eta beren
 infinitua izango da ia-ia.
Ur disoluzioetan ez dago bereziketarik egiterik
infinitua izango da ia-ia.
Ur disoluzioetan ez dago bereziketarik egiterik  baino sendoagoak diren azidoen artean. Horretarako disolbatzaile azidoagoa erabili behar litzateke.
Beste horrenbeste gertatzen da
baino sendoagoak diren azidoen artean. Horretarako disolbatzaile azidoagoa erabili behar litzateke.
Beste horrenbeste gertatzen da  ioiarekin,
izan ere hori da ur disoluzioetan ager daitekeen baserik sendoena; bera baino sendoagoak diren baseek portaera bera dute ur disoluzioetan,
bereizezinak dira. Base horiek bereizi ahal izateko base sendoagoa erabili behar da.
ioiarekin,
izan ere hori da ur disoluzioetan ager daitekeen baserik sendoena; bera baino sendoagoak diren baseek portaera bera dute ur disoluzioetan,
bereizezinak dira. Base horiek bereizi ahal izateko base sendoagoa erabili behar da.
Azido-base pareen sendotasuna ematen duten taulak azido-base erreakzioen norabidea aurrez
antzemateko erabil daitezke: azido batek protoia emango dio berak baino indar gutxiago duen azidobase pareko baseari. Adibidez:
 parearen oreka-konstantea
parearen oreka-konstantea
 izanik,
izanik,
 azidoak
protoia emango dio beste edozein pareko baseari, azido-base parearen balioa hori baino txikiagoa bada, adibidez,
azidoak
protoia emango dio beste edozein pareko baseari, azido-base parearen balioa hori baino txikiagoa bada, adibidez,
 pareko basearekin
pareko basearekin
 baita.
baita.
Garrantzi handikoa da ez nahastea azido baten indarra molekulak duen hidrogeno kopuruarekin.
Protoi bakarra eman dezaketen azidoak azido monoprotidoak dira
 .
Adibidez, azido azetikoa
.
Adibidez, azido azetikoa  monoprotidoa da, bere hidrogenoetatik bakarra aska dezakeelako. Azido diprotidoak bi protoi askatzeko ahalmena dutenak dira
monoprotidoa da, bere hidrogenoetatik bakarra aska dezakeelako. Azido diprotidoak bi protoi askatzeko ahalmena dutenak dira
 ; tripotridoak,
hiru protoi askatzeko ahalmena dutenak
; tripotridoak,
hiru protoi askatzeko ahalmena dutenak  , etab.
Baina aipatutako adibideetatik
, etab.
Baina aipatutako adibideetatik  (azido diprotidoa) ahulagoa da
(azido diprotidoa) ahulagoa da  baino (azido monoprotidoa).
baino (azido monoprotidoa).
Azido poliprotidoek ez dituzte aska ditzaketen protoiak denak batera eta erreakzio batean askatzen, etapaka baizik eta gero eta zailtasun handiagoz. Azido ortofosforikoa azido triprotidoa da, eta hiru alditan askatzen ditu bere hiru elektroiak:a
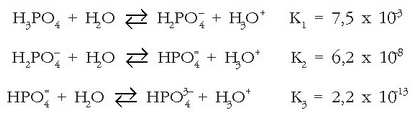
Lehenengo protoia askoz errazago askatzen du bigarrena baino eta hau errazago hirugarrena baino,
oreka bakoitzari dagokion oreka-konstantearen balioek erakusten duten bezala:
 Azido ortofosforikoa uretan jarritakoan hiru orekak hirurak bateragertatuko dira eta erreakzioetan
idatzi diren gai guztiak egongo dira disoluzioetan:
Azido ortofosforikoa uretan jarritakoan hiru orekak hirurak bateragertatuko dira eta erreakzioetan
idatzi diren gai guztiak egongo dira disoluzioetan:
 , bakoitza kantitate jakin batean,
oreka-konstanteek duten balioaren arabera.
Hala adibidez, oso
, bakoitza kantitate jakin batean,
oreka-konstanteek duten balioaren arabera.
Hala adibidez, oso  gutxi egongo da.
gutxi egongo da.
0,1 M-eko bi disoluzio bata azido azetikozkoa eta bestea azido zianurozkoa,
 -na
nahasten direnean, erreakzio hau gerta daiteke:
-na
nahasten direnean, erreakzio hau gerta daiteke:

nahiz alde batera nahiz bestera. Erreakzioan parte hartzen duten azido-base pareen oreka-konstanteak ezagututa erraz erabaki daiteke zein izan den erreakzioaren noranzkoa:

Bi oreka-konstanteetatik lehenengoa da handiena, beraz azido-base pareko
 azidoak (azido azetikoa) emango dio protoia bigarren pareko
azidoak (azido azetikoa) emango dio protoia bigarren pareko
 baseari
baseari
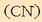 , eta oreka eskuinera alderatuko da batez ere.
, eta oreka eskuinera alderatuko da batez ere.
Dagokion oreka-konstantea ere erraz kalkula daiteke, adierazpen hauek kontuan hartuz gero:

Beraz: 
Ikusten denez, errakzioaren norabideaz esandakoa baieztatzen da.
Uraren ioitzea
Azido-base pareen indar erlatiboa neurtzeko ura hartzen da erreferentzia; beraz uraren indarra neurtzeko erreakzio honen orekakonstantea neurtu behar da:

Uraren kontzentrazioa konstantetzat harturik (55,5 mol/l gutxi gora behera):

Konstante honi uraren ioi biderkadura esaten zaio eta bere balioa, 25°C-tan,
 da.
da.
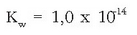
Hortik ur garbiaren hidronio eta hidroxilo ioien kontzentrazioa atera daiteke:
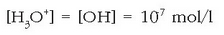
Uretan azidoren bat disolbatzen bada, ez da betetzen adierazpen hori, azidoak hidronio ioiak sortzen baititu eta
 kontzentrazioa handiagoa egiten delako
kontzentrazioa handiagoa egiten delako
 baino. Beraz kasu honetan ondoko adierazpena beteko da:
baino. Beraz kasu honetan ondoko adierazpena beteko da:
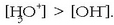
Basea bada uretan disolbatzen dena, berriz ere hidronio eta hidroxilo kontzentrazioen baliokidetasuna hautsiko da,
handiagoa izango baita hidroxilo ioien kontzentrazioa:

Laburtuz ur soluzioak neutroak izan daitezke, edo azidoak edo basikoak, ondoren ematen den taulan ageri diren balioen arabera:

Hidronio eta hidroxilo ioien artean dagoen adierazpenak, ur disoluzioen kasuan, aukera ematen du
edozein azido-base sistemako azidoaren eta basearen indarrak neurtzeko. Hori ikusteko azido batek (HA) eta
bere base konjugatuak  urarekin eratzen dituzten erreakzioak idatziko dira:
urarekin eratzen dituzten erreakzioak idatziko dira:
Azidoa: 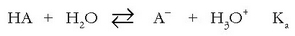
Base konjugatua: 
Batuketa: 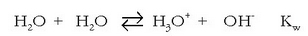
Azidoaren eta basearen adierazpenetatik: 
Eta hortik: 
Adierazpen honen bidez,  ezagututa
ezagututa  kalkula daiteke, eta alderantziz.
Horregatik azido-base taulen balioetan azidoen balioak
azaltzen dira bakarrik.
kalkula daiteke, eta alderantziz.
Horregatik azido-base taulen balioetan azidoen balioak
azaltzen dira bakarrik.
pH-aren kontzeptua
 eta OH - ioiek ur disoluzioetan gertatzen diren erreakzio askotan parte hartzen dute.
Oso kontzentrazio txikiak izan ohi dira, baina oso aldaketa handiak eragin ditzateke;
horregatik kontzentrazioak adierazteko modu berezia erabiltzen da.
eta OH - ioiek ur disoluzioetan gertatzen diren erreakzio askotan parte hartzen dute.
Oso kontzentrazio txikiak izan ohi dira, baina oso aldaketa handiak eragin ditzateke;
horregatik kontzentrazioak adierazteko modu berezia erabiltzen da.
Ikusi den bezala, hidronio ioien eta hidroxilo ioien kontzentrazioak ur disoluzioetan uraren ioi biderkaduraren bidez daude erlazionatuta; nahikoa da, beraz, ioi horietako baten kontzentrazioa zenbatekoa den jakitea, bestearen kontzentrazioa kalkulatzeko. Normalean hidronio ioien kontzentrazioa eman ohi da eta uraren ioi biderkaduraren bidez hidroxilo ioiena kalkulatzen da.
Hidronio ioen kontzentrazioaren baliorik handiena, oro har, batekoa da, hots
 ;
eta txikiena
;
eta txikiena  -koa,
beraz,
-koa,
beraz, 
 .
.
Kontzentrazio hauek adierazteko pH-aren kontzeptua asmatu zuen Sorensenek 1909an. Definizio hau eman zuen:
hidronio ioien kontzentrazioaren logaritmo hamartarra, zeinua aldatuta, hau da
 .
Kontuan izanda kontzentrazio horien balioak 1 eta
.
Kontuan izanda kontzentrazio horien balioak 1 eta
 artekoak direla,
pH-aren balio arruntak 0 eta 14 artekoak izango dira. pH-a kalkulatzeko zeinua aldatzen dugunez, pH-a handiagoa egingo da
zenbat eta txikiagoa izan hidronio ioen kontzentrazioa, eta alderantziz. Hidronio ioien kontzentrazio handi bati –disoluzio azidoa–,
pH txikia egokituko zaio. Alderantziz, hidronio ioien kontzentrazioa txikia denean –disoluzio basikoa– pH handia izango da.
artekoak direla,
pH-aren balio arruntak 0 eta 14 artekoak izango dira. pH-a kalkulatzeko zeinua aldatzen dugunez, pH-a handiagoa egingo da
zenbat eta txikiagoa izan hidronio ioen kontzentrazioa, eta alderantziz. Hidronio ioien kontzentrazio handi bati –disoluzio azidoa–,
pH txikia egokituko zaio. Alderantziz, hidronio ioien kontzentrazioa txikia denean –disoluzio basikoa– pH handia izango da.
Ondoko irudian hidronio ioien eta hidroxilo ioien kontzentrazioen arabera gertatzen diren pH-aren aldaketak ikus daitezke.

pH-aren eboluzioa hidronio ioien (H3O+) eta hidroxilo ioien (OH-) kontzentrazioarekin
Disoluzio azido, base eta neutroen definizioetatik beste erlazio hauek ateratzen dira:
Disoluzio azidoa: p H < 7
Disoluzio basikoa: p H > 7
Disoluzio neutroa: p H = 7
0,055 M-ko azido nitrikozko  disoluzioaren pH-a oso erraz kalkula daiteke, kontuan izanik azido nitrikoa azido sendoa dela eta uretan guztiz disoziatuta dagoela.
Horren arabera, hidronio ioien kontzentrazioa azidoaren beraren kontzentrazioaren baliokidea izango da:
disoluzioaren pH-a oso erraz kalkula daiteke, kontuan izanik azido nitrikoa azido sendoa dela eta uretan guztiz disoziatuta dagoela.
Horren arabera, hidronio ioien kontzentrazioa azidoaren beraren kontzentrazioaren baliokidea izango da:
 .
Honen logaritmo hamartarra, berriz: log 0,055 = - 1,259637 da, eta horrenbestez, zeinua aldatuta: pH = 1,26.
.
Honen logaritmo hamartarra, berriz: log 0,055 = - 1,259637 da, eta horrenbestez, zeinua aldatuta: pH = 1,26.
0,025 M-ko potasio hidroxidozko (KOH) soluzioaren pH-a ere kalkula daiteke.
Aurreko adibidean bezala, base hau sendoa denez, hidroxilo ioien kontzentrazioa
basearen beraren kontzentrazioa izango da: 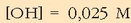 .
pH-a kalkulatzeko hidronio ioien kontzentrazioa zenbatekoa den jakin behar da, baina jakinik ur disoluzioetan beti betetzen dela
.
pH-a kalkulatzeko hidronio ioien kontzentrazioa zenbatekoa den jakin behar da, baina jakinik ur disoluzioetan beti betetzen dela

 adierazpena, aski
da ordezkaketa egin eta ekuazioa askatzea:
adierazpena, aski
da ordezkaketa egin eta ekuazioa askatzea:

Logaritmo hamartarra kalkulatzen da ondoren,
 ,
,
eta zeinua aldatuz pH = 12,40 emaitza lortzen da.
Arazoa konplexuagoa da uretan disolbatutako azidoa edo basea ahulak direnean. 0,1 M den amoniakozko
 disoluzio baten pH-a kalkulatzeko,
base hau ahula denez, basearen disoziazio-konstantea zenbatekoa den jakin behar da:
disoluzio baten pH-a kalkulatzeko,
base hau ahula denez, basearen disoziazio-konstantea zenbatekoa den jakin behar da:


Hala ere bi hurbilketa egin ohi dira:
1.- Disoluzioetako hidronio edo hidroxilo ioiak azidoak edo baseak erakarriak direla suposatzen da,
eta ez urak erakarriak. Salbuespenik badago, azido ala basea oso-oso ahulak diren disoluzioetan, disoziazio-konstantea
 -koa denean alegia.
-koa denean alegia.
2.- Azidoaren edo basearen disoziazio-maila, a, oso txikia da.
Hurbilketa horiek kontuan izanda honelaxe adieraz daiteke amoniakoaren disoziazioa:

disoziazioa gertatu aurretik

orekan

Oreka-konstantea:

Horretara iristeko  oso txikia dela suposatu da:
oso txikia dela suposatu da:
Ordezkaketa eginez: 
Beraz: 
Hidronio ioien kontzentrazioa:

Logaritmoa: 
Zeinua aldatuta: 
Izadiko indikatzailea
Larrosa gorri bati kolorea ematen dion gaia metanoletan disolbatuz, disoluzio gorria lortuko da. Larrosa zeharo kolorgetuta geratu da, ezkerreko ontzian ikusten denez. Eskuineko ontzian koloregaia ikusten da, metanoletan disolbatuta.
Disoluzio hori indikatzaile gisa erabil daiteke. Ontzi txikietan pH ezberdineko disoluzioak daude; indikatzaileak pH-aren arabera har ditzakeen koloreak ikusten dira ontzi horietan.
Antiazidoak
Gure urdaileko pH-a azidoa da, baina batzuetan gehiegi jateagatik edo beste zerbaitegatik,
pH-a azidoegia bihur daiteke eta orduan antiazidoak erabiltzen dira. Antiazido erabilienak kaltzio
karbonatoa, magnesio karbonatoa eta magnesio hidroxidoa dira
 Urdaileko paretetan dauden muki mintzek txegoste urinak jariatzen dituzte, azido klorhidrikoa (HCl)
eta pepsinogenoa (gero pepsina entzima bihurtuko dena), besteak beste. Bi osagai horiek garrantzi
handiko zeregina betetzen dute txegosketan. Urdaileko pH normala 1,2 eta 3,0 artekoa da; zinka era
disolba dezake pH horrek. Urdaila babesten duen estaldura bera ere desegin egiten da ingurune azido horretan,
baina berehala sortzen da berriro (milioi erdi zelula inguru sortzen da minutuko).
Gehiegi jan ondoren urdailak azido klorhidriko asko jariatzen du, eta txegostea astuna gertatzen da.
Gehiegizko azido hori neutralizatzeko antiazidoak hartu ohi dira. Hona hemen erabilienetako batzuk:
Urdaileko paretetan dauden muki mintzek txegoste urinak jariatzen dituzte, azido klorhidrikoa (HCl)
eta pepsinogenoa (gero pepsina entzima bihurtuko dena), besteak beste. Bi osagai horiek garrantzi
handiko zeregina betetzen dute txegosketan. Urdaileko pH normala 1,2 eta 3,0 artekoa da; zinka era
disolba dezake pH horrek. Urdaila babesten duen estaldura bera ere desegin egiten da ingurune azido horretan,
baina berehala sortzen da berriro (milioi erdi zelula inguru sortzen da minutuko).
Gehiegi jan ondoren urdailak azido klorhidriko asko jariatzen du, eta txegostea astuna gertatzen da.
Gehiegizko azido hori neutralizatzeko antiazidoak hartu ohi dira. Hona hemen erabilienetako batzuk:

Antiazido batzuk uretan disolbatutakoan (Alka Seltzerra adibidez) burbuilak sortzen dira. Izan ere, haren azido zitrikoak bikarbonatoarekin
 eta karbonato anioiarekin
eta karbonato anioiarekin
 erreakzionatzen baitu, eta
erreakzionatzen baitu, eta
 askatzen da:
askatzen da:

Erreakzio honetan sortutako zitrato sodikoa  ere antiazido bat da, azido ahul baten gatz sodikoa baita
ere antiazido bat da, azido ahul baten gatz sodikoa baita
METALEN ETA EZ-METALEN KLORUROEK EZ DUTE BERDIN JOKATZEN URAREN AURREAN
Irudian agertzen diren hiru ontzietan ura dago, metil gorri pixka batekin.
Ezkerraldeko erloju-beiran sodio kloruroa (metal baten kloruroa) dago, erdiko ontzi txikian fosforo trikloruroa,
 (ez-metal baten kloruroa).
eta eskuineko erlojubeiran fosoforo pentakloruroa,
(ez-metal baten kloruroa).
eta eskuineko erlojubeiran fosoforo pentakloruroa, 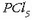 (ez-metal beraren beste kloruro bat).
(ez-metal beraren beste kloruro bat).
Urari sodio kloruroa botatzerakoan (ezkerreko ontzia) ez da inongo kolore aldaketarik ikusten.
Erdiko ontzian, aldiz, kolore aldaketa ikusten da  gehitutakoan: ura arrosa koloreko bihurtzen da. Eta beste horrenbeste gertatzen da
gehitutakoan: ura arrosa koloreko bihurtzen da. Eta beste horrenbeste gertatzen da
 nahasten zaion urarekin.
nahasten zaion urarekin.
Sodio kloruroa disolbatu besterik ez da egiten uretan, ez du erreakziorik ematen.
Fosforo trikloruroak urarekin erreakzionatzen du, eta azido fosforosoa lortzen da errakzio honetan
 ;
azido horren eraginez metil gorriaren kolorea aldarazten du pH-a aldatzen denean. Fosforo pentakloruroak
ere urarekin erreakzionatzen du, eta azido fosforikoa ematen
;
azido horren eraginez metil gorriaren kolorea aldarazten du pH-a aldatzen denean. Fosforo pentakloruroak
ere urarekin erreakzionatzen du, eta azido fosforikoa ematen
 honek ere pH-a aldatzen
du eta metil gorriaren kolore aldaketa gertatzen da.
honek ere pH-a aldatzen
du eta metil gorriaren kolore aldaketa gertatzen da.
Indikatzaileak
Disoluzioaren pH-ak eragin handia du prozesu kimiko eta biologiko askotan eta, horregatik, bere balioa zein den jakitea garrantzi handikoa da. Zenbaitetan kalkulurik egin gabe neur daiteke disoluzio baten pH-a. Gehien-gehienetan bai industrian bai prozesu biologikoetan, behar-beharrezkoa izaten da pH-a neurtzea. Neurketa pH-metro deritzen gailuez egiten da.
Gutxi gorabeherako pH-a, hala ere, indikatzaileen bidez jakin daiteke. Indikatzaileak koloregai organiko konplexu samarrak dira, disoluzioaren pH-aren arabera kolore jakin bat ala beste bat hartzen dutenak. Azido ala base ahulak izan ohi dira, eta kolor e ezberdinekoak haien base edo azido konjugatuak.
Metil laranja, adibidez, azido ahula da. Bere molekula konplexua denez, InH adieraziko dugu.
Molekula osoaren kolorea gorria da; eta bere base konjugatua, berriz,
 anioia, horia. Disoluzioetan oreka gertatzen da:
anioia, horia. Disoluzioetan oreka gertatzen da:

Normalean biak agertzen direnez, azidoa (gorria) eta bere base konjugatua (horia), disoluzioak kolore laranja hartzen du, eta horregatik du izen hori indikatzaileak.
Disoluzio azidoetan  -aren
kontzentrazioa handia denez, oreka ezkerrera egongo da alderatua eta indikatzaileak, bere forma azidoaren eraginez, kolore gorria hartuko du.
-aren
kontzentrazioa handia denez, oreka ezkerrera egongo da alderatua eta indikatzaileak, bere forma azidoaren eraginez, kolore gorria hartuko du.
Basea eranstean, ostera, hidroxilo ioiek  ioiekin erreakzionatuko dute, eta hauen kontzentrazioa jaitsi egingo da. Eskuineranzko alderaketa gertatuko da orekan eta
ioiekin erreakzionatuko dute, eta hauen kontzentrazioa jaitsi egingo da. Eskuineranzko alderaketa gertatuko da orekan eta
 -a eratuko denez kolore horia hartuko du disoluzioak.
-a eratuko denez kolore horia hartuko du disoluzioak.
Kolore aldaketa ondo ikus dadin behar-beharrezkoa da era azidoaren eta era basikoaren kontzentrazioak oso ezberdinak izatea, hamar bat aldiz handiagoa batena bestearena baino. Kolore aldaketa, beraz, ez da pH finko batean gertatzen, pH-aren balio tarte batean baizik. Taulan zenbait indikatzaileren koloreak eta kolore aldaketa gertatzen diren pH-aren tarteak ikus daitezke.

Indikatzaileak azido-base bolumetrietan baliokidetasun puntua ikusteko erabiltzen dira batez ere.
Hidrolisia
Zenbait gatz neutroren (ez dute H edo OH-rik) disoluzioak, pentsa daitekeenaren kontra, basikoak izan daitezke ala azidoak.
Sodio karbonatoa  edo sodio azetatoa (NaAc) uretan disolbatutakoan, paper indikatzailearen bitartez froga daitekeen bezala, disoluzioa basikoa da.
Amonio kloruroa
edo sodio azetatoa (NaAc) uretan disolbatutakoan, paper indikatzailearen bitartez froga daitekeen bezala, disoluzioa basikoa da.
Amonio kloruroa 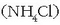 edo aluminio
kloruroa
edo aluminio
kloruroa 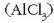 uretan disolbatutakoan,
ostera, disoluzio azidoa baten aurrean gaude. Nola uler daiteke, denak gatz neutroak izanda, batzuek izaera basikoa ematea
disoluzioari eta besteek azidoa?
uretan disolbatutakoan,
ostera, disoluzio azidoa baten aurrean gaude. Nola uler daiteke, denak gatz neutroak izanda, batzuek izaera basikoa ematea
disoluzioari eta besteek azidoa?
Gatzak ematen dituen ioietarik batek urarekin erreakzionatzen du askotan; horrela uler daiteke hor emandako konportamolde hori. Ioiak urarekin erreakzionatzen duenean, prozesuari hidrolisia esaten zaio.
Bronsted-Lowry-ren teorian hidrolisia azido-base erreakzioa besterik ez da; batzuetan anioiak (basea) erreakzionatzen du urarekin eta beste batzuetan katioiak (azidoa).
Azter dezagun motz-motz bada ere,
 anioiaren hidrolisia.
Azetatoa, zianuroa... izan daiteke anioia, beti, nahi eta nahi ez azido ahul baten (azido azetikoa, azido zianhidrikoa...) base konjokatua.
Hidrolisi erreakzioa hauxe da:
anioiaren hidrolisia.
Azetatoa, zianuroa... izan daiteke anioia, beti, nahi eta nahi ez azido ahul baten (azido azetikoa, azido zianhidrikoa...) base konjokatua.
Hidrolisi erreakzioa hauxe da:
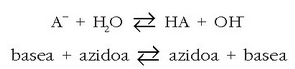
Erreakzio honen oreka-konstantea, normalean hidrolisi konstantea deritzona, A - basearen konstantea da:

Azido baten konstantea bider bere base konjokatuaren konstantea, dakigunez, uraren ioi-biderkadura,
 da:
da:

Beraz ezaguna dugu hidrolisi-konstantea, ezaguna izanda, azido konjokatuaren konstantea:

Katioi baten,  , hidrolisia guztiz antzerakoa da:
, hidrolisia guztiz antzerakoa da:

Era berean:

0,1 M den amonio bromurozko disoluzioa dugu eta pH-a zein den jakin nahi da. Ezaguna da, horretarako, amoniakoaren konstantea:

Disoluziotan amonio bromuroa guztiz disoziatuta dago:

 -aren base konjokatua
-aren base konjokatua
 -a da eta base ahula da;
beraz gerta daiteke amonio ioiaren hidrolisia:
-a da eta base ahula da;
beraz gerta daiteke amonio ioiaren hidrolisia:

Honi dagokion konstantea hidrolisi-konstantea da edo, nahi bada,
 azidoaren konstantea:
azidoaren konstantea:

Badakigu jakin ere:

Ordezkatuz hidrolisi-konstantean:
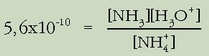
pH-a kalkulatzeko bi hurbilketa egin ohi dira:
1. Hidronio ioi guztiak  hidrolisiaren eraginez sortu dira. 1. Jakin badakigu uraren disoziazioz ere sortuak direla baina despreziatu egingo
ditugu besteen aurean. Hala bada, hauxe idatz daiteke:
hidrolisiaren eraginez sortu dira. 1. Jakin badakigu uraren disoziazioz ere sortuak direla baina despreziatu egingo
ditugu besteen aurean. Hala bada, hauxe idatz daiteke:
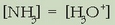
2. Hidrolisian gastatzen diren  ioiak oso gutxi dira disoluziotan zeudenekin konparatuz gero. Beraz:
ioiak oso gutxi dira disoluziotan zeudenekin konparatuz gero. Beraz:
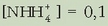
Ordezkatuz:

Ebatziz:
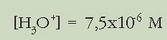
Eta pH-a:

ZENBAIT INDIKATZAILEREN KOLOREAK
Ezkerretik eskuinera: metil gorria, fenoftaleina, bromotimol urdina eta indikatzaile unibertsala. Metil gorriak, bromotimol urdinak bezala, pH = 5 / pH = 7 tartean aldatu du bere kolorea. Fenoftaleinak, berriz, pH = 7 / pH = 9 tartean.





