Fisika-Kimika»Fisika - Kimika
Substantzia sinpleak eta konposatuak
Kimikaren munduan oinarrizko kontzeptuetako bat elementu edo substantzia sinplearena da. Gorputz natural eta sintetiko asko eta asko aurkitu dira, baina gorputz horietatik ehun inguru besterik ez dira oinarrizkoak. Oinarrizko gai horiei elementu kimiko esaten zaie; guztira ehun elementu dira, baina horietatik 50 inguru dira erabilienak edo ezagunenak; gainerakoak sintetikoak eta oso arraroak dira. Elementu kimikoak era eta proportzio desberdinetan konbinatzen dira elkarren artean eta elkarketa horri esker daude hainbeste gorputz edo substantzia desberdin.
Dena dela, gorputzen artean bereizketa nabarmen bat egin daiteke:
batetik gai sinpleak daude, eta konposatuak bestetik.
Gai sinpleak elementu bakar edo substantzia sinple batez osatuak dira; adibidez, diamantea,
karbonoz soilik osatua; ozonoa, oxigenoz bakarrik osatua
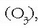 , etab.
Substantzia konposatuek, aldiz, elementu bat baino gehiago dituzte osagai; adibidez, urak hidrogenoa eta oxigenoa ditu osagai,
azido sulfurikoak hidrogenoa, oxigenoa eta sufrea
, etab.
Substantzia konposatuek, aldiz, elementu bat baino gehiago dituzte osagai; adibidez, urak hidrogenoa eta oxigenoa ditu osagai,
azido sulfurikoak hidrogenoa, oxigenoa eta sufrea 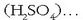
Bestalde, elementuek edo gaiek elkarrekin konbinatzean era askotako erreakzioak eragiten dituzte. XVIII. mendearen bigarren erdialdea arte kimikariek erreakzioak gertarazten zituzten eta liburuetan idazten zuten erreakzio horietan gertatutako guztia. Baina ez zegoen araurik edo legerik, itxuraz behintzat, erreakzio horiei buruz. Antoine Laurent Lavoisier zientzialaria izan zen kimikaren munduan urrats garrantzitsu hori bete zuena. Lavoisier 1743an jaio zen Parisen eta 1784ko maiatzaren 8an, Frantziako Iraultzaren garaian, gillotinan hil zuten. Metodo zientifikoa aplikatu zuen bere lanetan eta sistematizazio ezari amaiera eman zion horrela. Haren eskutik esan daiteke jaio zela kimika zientzia gisa
Ponderazio legeak
Kimikako oinarrizko legeei esaten zaie ponderazio legeak. Lege hauek guztiak masarekin erlazionatuta daude, eta hortik datorkie izena (latinez pondus = pisua).
Masaren iraunkortasunaren legea
Erreakzio bat gertatutakoan sistema osoaren masarekin zer gertatuko den jakin nahi izatea izan da kimikarien ardura nagusietako bat. Aspaldiko alkimistek ere izan zuten hori aztertzeko ardurarik, eta erreakzioaren amaieran hasieran baino gramo gehiago ala gutxiago zeudela aurkitu ohi zuten sarritan. Adibidez, burdina airean utzi eta herdoila sortzean, burdinak pisu handiagoa zuen erreakzioaren bukaeran hasieran baino. Aldiz, kareharria berez kare bihurtzean pisua galtzen zuela zirudien. Hori dela eta, Lavoisierren ekarpen nagusia balantzaren erabilera izan zela esan daiteke. Izan ere, erreakzio batean parte hartzen duten substantzia guztiak (baina substantzia guztiak, ikusten direnak eta ez direnak, isurkariak eta gasak… etab.) erreakzioa hasi aurretik eta erreakzioaren ondoren pisatuko balira, balegoke esaterik erreakzioaren ondorioz sistemaren masa aldatu den ala ez. Eman dezagun zehaztasun handikobalantza batean argazkiak ateratzeko flash bonbila bat, erabili gabea, pisatu dela. Bonbilaren barruan aluminioa, hauts moduan, eta oxigenoa daude. Argazkia ateratzean bonbila horren barruan aluminio oxidoa sortuko da eta argia ikusiko da bat-batean, argazkia ateratzeko adina argi hain zuzen. Bonbila itxita dagoenez, erreakzioa gertatu ondoren ere bonbila barruan egongo dira hasierako elementu guztiak. Eta erreakzioa amaitu ondoren berriro bonbila pisatuz gero, pisu aldaketarik ez dela egon froga daiteke.
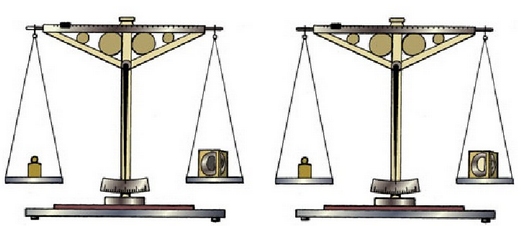
Balantza erromatarrean pisua neurtzen, erreakzio aurretik eta ondoren.
Hau da Lavoisierren legea:
Erreakzio kimiko batean erreakzionatzen duten gaien masa totala eta lortutako produktuen masa totala berdinak izango dira.
Gaur egungo ikuspuntutik lege hau bat-batekoa dela badirudi ere, eta zehaztasun handiagoz hitz eginez,
legea ez dela guztiz egia esan beharko litzatekeen arren, bere garaian izugarrizko aurreramendua izan zen.
1916an Albert Einsteinek Erlatibitatearen Teoria Orokorra eman zuen argitara eta masa eta energia lotzen dituen ekuazioa azaldu zuen:
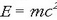 Ekuazio horren arabera, masa energia
bihur daiteke eta alderantziz. Baina, hala ere, erreakzio arruntetan
energia bihur daitekeen masa kantitatea oso txikia denez,
ontzat har daiteke Lavoisierren legea; Einsteinek proposatutako energia/
masa baliokidetasunak erreakzio nuklearretan du eragina batez ere
Ekuazio horren arabera, masa energia
bihur daiteke eta alderantziz. Baina, hala ere, erreakzio arruntetan
energia bihur daitekeen masa kantitatea oso txikia denez,
ontzat har daiteke Lavoisierren legea; Einsteinek proposatutako energia/
masa baliokidetasunak erreakzio nuklearretan du eragina batez ere
Proportzio finkoen legea edo Prousten legea
Lavoisierrek elementuak eta substantzia konposatuak bereizi zituen, baina ez zuen zehaztu substantzia konposatuak sortzerakoan elementuak zein proportziotan konbinatzen ziren, edo proportzio hori finkoa ala aldakorra zen. Louis Joseph Proust frantziar kimikariak (1754-1826) eman zion erantzuna arazo horri 1801ean, Lavoisierrek gaien pisua neurtzeko moldatu zuen teknikari jarraituz. Ordu arte substantzia konposatuek soluzioen antza zutela onartzen zen, hots, substantzia konposatu bat sortzeko ez zegoela substantzia konposatu horren osagaiak beti proportzio berean nahastu beharrik, disoluzio bat gertatzerakoan disolbatzailearen eta solutuaren proportzioak beti berdinak ez diren bezala.

Adibidez, ontzi batean ura ipini eta uretara gatza botatzen badugu, nahasteari eragin ondoren isurkari edo likido garden bat ikusiko dugu, ur gazitua hain zuzen (disoluzio homogeneo bat, beraz). Ur gazitu horri gatz gehiago gehituz gero, isurkariaren itxura ez da aldatuko, gatz guztia disolbatuko baita uretan. Gatza botatzen segituz gero, ordea, halako batean, soluzioa ase egiten da; hau da, gatz gehiago gehitzerakoan ez da gehiago disolbatuko, eta ontziaren hondoan gatza agertuko da, disolbatu gabea. Horrela, disoluzio batean, disoluzioaren osagaien proportzioakez du zertan beti berdina izan behar; adibidez, ur eta gatz pr o- portzio desberdinak nahastuta ere ur gazitua lortuko da beti. Baina substantzia batzuen arteko erreakzioetan ez da beti hala izango, batzuetan beste substantzia bat sortuko baita. Beraz, erreakzioan parte hartzen duten gaien proportzioaren arabera bi aukera egongo dira: beti produktu berdina lortzea (alegia, ez da erreaktiboetako baten beharrik gehiago izango), edo erreaktiboen arteko proportzioak aldatu ahala produktu desberdinak lortzea (ura / ur oxigenatua).
Uraren kasuan, adibidez, uraren pisuaren neurtze zehatzak eginez zera ikusi zen: hidrogenoa eta oxigenoa erreakzioan sarraraztean, beraien arteko proportzioak 1:7,936 behar zuen izan, bakar bakarrik ura emango bazuten. Erreaktiboetan proportzio hori betetzen ez bazen, bi gaietako bat soberakin gisa geratzen da erreakzioa amaitu ondoren.
Honela dio proportzio finkoen legeak:
Elementu bat baino gehiago konposatu jakin bat emateko elkarrekin konbinatzen direnean, beren masak proportzio finko batean konbinatuko dira beti.
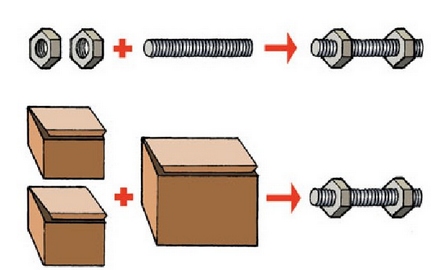
Bi tuerka edo bi tuerka kaxa erabilita, beti proportzio bera mantentzen denez, beti produktu bera lortuko da
Proportzio anizkoitzen legea edo Daltonen legea
Batzuetan bi elementuren konbinaziotik konposatu bat baino gehiago lor daitezke. Adibidez, kobrea oxigenoarekin konbinatzen denean, batzuetan kobre (I) oxidoa ematen du, eta beste batzuetan, berriz, kobre (II) oxidoa. Gauza bera gertatzen da burdinarekin: burdin (II) oxidoa eta burdin (III) oxidoa. Hala ere, konposatu hauetako bakoitzaren kasuan bete egiten da proportzio finkoen legea:
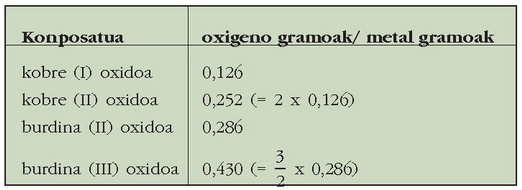
Kobrearen kasuan zera esan daiteke: metalaren kantitate jakin bat hartuz gero (1 g), oxigenoak kobrearekin erreakzionatzean lortzen diren bi oxidoetan parte hartzen duten oxigeno kantitateek elkarren artean 1:2 (0,252/0,126) proportzioa beteko dute. Burdinaren kasuan, berriz, metalaren kantitate jakin batentzako bi oxidoetan parte hartzen duten oxigeno kantitateek 2:3 erlazioa dute.
John Daltonek (1766-1844) honela adierazi zuen, 1803an, proportzio anizkoitzen legea:
Bi elementu konposatu bat baino gehiago emateko elkarrekin konbina daitezkeenean, elementuetako baten kantitate finko batekin erreakzionatuko duten bestearen kantitateek beraien artean erlazio sinple bat beteko dute: 1:2, 1:3, 2:3… etab.
Alderantzizko proportzioen legea edo Richterren legea
Jeremias Benjamin Richter (1762-1807) kimikari alemaniarrak lege hau zuzenean adierazi ez bazuen ere, haren izena jarri zaio. Izan ere, Richterrek, Lavoisierren metodo zientifikoari jarraituz, Daltonek bere legea proposatu baino 10 urte lehenago alderantzizko proportzioen legearen adibide baten berri eman zuen. Gramo bat oxigeno hidrogenoarekin, magnesioarekin, sufrearekin eta kloroarekin konbinatzen denean ura, magnesio oxidoa, sufre dioxidoa eta kloro monoxidoa emateko hurrenez hurren, bigarren osagai horietatik 0,126 g, 1,52 g, 1,00 g eta 4,43 g erabili behar dira. Aitzitik, magnesioa sufrearekin konbinatzerakoan 1,52:1 erlazioa betetzen da, eta kloroarekin erreakzionatzean, berriz, 1,52:4,43 erlazioa. Beraz, elementu jakin batekin (oxigenoarekin, kasu honetan) konbinatzen diren elementuen (magnesioa, sufrea, kloroa eta hidrogenoa, kasu honetan) lehenengo elementu horrekiko proportzioaren arabera zehaztuko da bigarren elementu horiek elkarrekin konbinatzean zer proportzio gordeko luketen. Beraz, Richterren legearen arabera:
Bi elementuk, A eta B, adibidez, beste elementu C delako baten kantitate berberarekin erreakzionatzen badute, A eta B elementuek elkarrekin erreakzionatzean bete beharko duten proportzioa C-rekin erreakzionatzean bete behar izan zuten bera izango da, edo kantitate horren anizkoitz sinplea, bestela.
Daltonen teoria atomikoa
Ponderazio legeak esperimentu bidez frogatu ondoren, izadian lege horiek adierazitako ordena mantentzen zela ikusi zen. Elementu kantitate handiak edo txikiak konbinatu ahal izango dira, baina beti proportzio bera beteko dute konbinazio horietan. Erlazio aritmetiko hauek azaltzeko Daltonek bere teoria atomikoa proposatu zuen.
1.- Elementuak atomoz osaturik daude, hots, partikula zatiezin eta puskaezinez.
2.- Elementu jakin baten atomoak elkarren berdinak dira, bai masari dagokionez bai gainerako propietate edo tasunei dagokienez.
3.- Bi edo elementu gehiago elkarrekin konbinatu eta konposatu bat osatzen dutenean, elementu horien atomoak zenbaki sinplezko proportzio batean konbinatuko dira. Elkarketatik sorturiko gaiaren osagaiak «atomo elkartuak» izango dira, eta konposatuan ere elkarren berdinak izango dira.
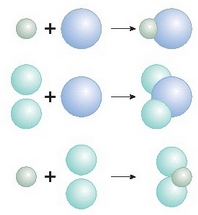
Daltonen teoria atomikoa gaur egun bazterrera gelditu bada ere, bere garaian garrantzi handia izan zuen. Izan ere, ponderazio legeak azal zitzakeen, eta baita gai batzuen zenbait propietate ere, hala nola, gasen konprimagarritasuna, gaien dilatazio termikoa, egoera fisikoen aldaketa, etab. Dena dela, teoria haren bidez ezin zen azaldu gasen arteko konbinazioetan ikusitako bolumenen proportzioak.
John Dalton
(1766-1844) John Dalton, ehule apal baten semea, Cumberland-en jaio zen, Ingalaterran. Bere herriskako eskolan hasi zen eta hainbeste aurreratu zuen denbora gutxian, ezen, hamabi urterako eskolako maisu bihurtu baitzen. Handik zazpi urtera eskolako zuzendari egin zuten. 1793an, Manchesterra joan zen bizitzera eta han bizi izandu zen geroztik. Matematika, fisika eta kimika irakasten zituen ikastetxe batean. Hala ere, obligazio horiek bere azterketa zientifikoak egiteko eragozpen zirela iritzi zionean, postua bertan behera utzi eta ikasle pribatuei matematika eta kimika irakasten hasi zen bere gastuei aurre egin ahal izateko. Ez zen ezkondu eta modu xume eta apalean bizi izandu zen beti, baita ospea izan zuenean ere. Lehen azterketa zientifikoak meteorologiaren alorrean garatu zituen eta bizi guztian izan zuen zaletasun hori: egunero jasotzen zituen tenperatura, presio barometriko edo plubiometria datuak. John Dalton izan zen koloreetarako itsutasuna deskribatu zuen lehenengoa, berak ere jasan baitzuen. Kuakero konbentzitua, Daltonek beti arropa xume eta ilunak jazten zituen. Horregatik, bere lagunak harriturik geratu ziren, 1832an, Gilen IV.a aurkeztu behar ziotela eta, janzkera eskarlataz azaldu zenean. Daltoni, ordea, gris iluna iruditu zitzaion eta kezka handirik gabe joan zen erregea ikustera.
1803an formulatu zuen Daltonek atomoen teoria. Esan zuen, gai osatuak, elementu desberdinen atomoen konbinazioz eratzen direla, zenbaki txiki osoek definitutako proportzioetan, baina ez zuen metodo fidagarririk atomoen konbinazio erlazioak zehaztu ahal izateko. Egoera horretan, uste izan zuen, bi elementuz –A eta B– osatutako konposatu batean, gai osatuaren formulak ahalik eta bakunena izan behar zuela: AB. Horretan oinarriturik, eta euren artean konbinatzen ziren zenbait elementuren masa atomikoak kontuan hartuta, lehenengo masa atomiko erlatiboak kalkulatzeko gai izan zen. Hala ere, gai osatuen formulei buruzko haren usteak ez ziren beti zuzenak izan. Adibidez, uste zuen uraren formula HO zela eta beraz, bere taulako zenbait masa atomiko gaizki kalkulatuak zeuden. Izan ere, kimikariak ez ziren 1858 arte, molekulen formulak – eta ondorioz masa atomikoak– behar bezela zehazteko gauza izan. Hala eta guztiz ere, Daltoni aitortu beharra dago bera izan zela lehena atomoen teoriari oinarri kuantitaboa ematen, eta urrats hori funtsezkoa izan zen kimikak handik aurrera izan zuen garapen azkarra ulertzeko.
Bolumenen legea gasen arteko erreakzioetan
Gasekin lanean erosoagoa eta errazagoa da haien bolumena neurtzea, pisua neurtzea baino. Horrexegatik gasen arteko erreakzioetan bolumenen arteko proportzioak aztertu ziren. 1808an Joseph Louis Gay-Lussac kimikari eta fisikari frantsesak (1778-1850) lege enpiriko hauek proposatu zituen:
1.- Edozein erreakzio kimikotan gas erreaktiboen bolumenek zenbaki sinplezko proportzioak beteko dituzte.
2.- Erreakzio kimikoan sortutako produktuaren bolumenak eta gas erreaktiboen bolumenen baturak zenbaki sinplezko proportzio bat betetzen dute.
Adibidez:
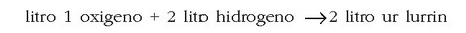
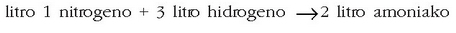
Daltonen teoria atomikoaren bidez ezin dira emaitza hauek azaldu. Izan ere, teoria horren arabera, erreakzioan 3 litro baziren, erreakzio horretatik lorturiko emaitzak ere 3 litrokoa behar luke izan.
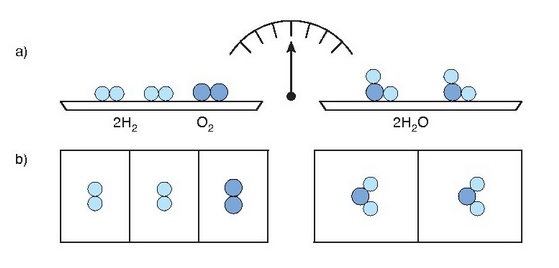
Erreakzio kimiko batean masa kontserbatzen den bitartean ez da gauza bera gertatuko bolumenarekin.
Daltonen teoria atomikoaren bidez ezin dira emaitza hauek azaldu. Izan ere, teoria horren arabera, erreakzioan 3 litro baziren, erreakzio horretatik lorturiko emaitzak ere 3 litrokoa behar luke izan.
Avogadroren hipotesia
Amadeo Avogadro (1776-1856) fisikariak —fisikako irakaslea Turingo unibertsitatean— emaitza horiek azaltzeko aukera ematen duen hipotesi bat proposatu zuen 1811. urtean: gasen osagaiak ez ziren atomo sinpleak, atomo sinpleen elkarketak baizik. Atomo talde horiei molekula esan zien. Presio eta tenperatura konstantean neurturiko zenbait gasen bolumenak berdinak baldin baziren, guztietan molekula kopuru bera egongo zen. Beraz, litro bat nitrogenotan eta litro bat oxigenotan edo litro bat amoniakotan beti molekula kopuru bera egongo da (baldin eta presio eta tenperatura berean badaude hiru gasak, noski). Beste era batera esanda, gas batek hartzen duen bolumena gas horren partikula kantitatearen araberakoa izango da, partikulen propietateak edozein direla ere.
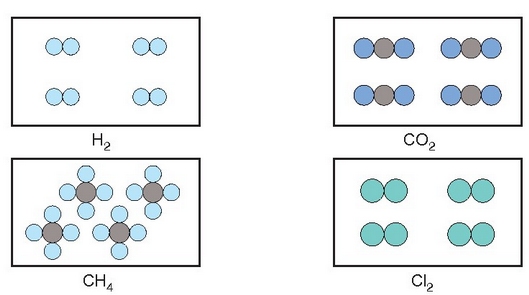
4 gas ezberdinen molekula kopuru berak beti bolumen bera beteko du
Zer gertatzen da, beraz, gasen arteko erreakzioetan? Gas arruntenak molekula diatomikoz osaturik daude (oxigenoa, nitrogenoa, hidrogenoa…), eta erreakzio bat gertatzen denean molekula horiek apurtu eta atomoak aske geratzen dira. Atomo horiek beste era batera konbinatuko dira gero eta molekula berriak sortuko dituzte. Ideia hauek ez zituzten onartu Avogadroren garaiko zientzilariek, aurrerakoiegiak baitziren. Baina berrogeita zazpi urte geroago Stanislao Cannizzaro (1826-1910) italiar kimikariak egiaztatu zuen hipotesi hau, gasen molekula masak neurtzeko metodoa proposatu zuenean.
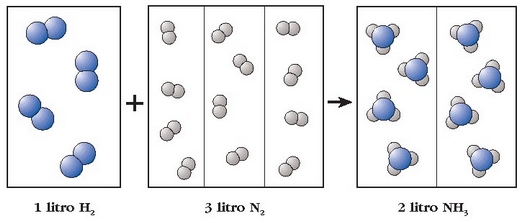
Adibidea. Litro bat nitrogenok 3 litro hidrogenorekin konbinatzean 2 litro amoniako ematen ditu. Nitrogenoaren molekulak diatomikoak direnez, litro bateko n molekulatan 2n atomo egongo dira eta hidrogenoaren kasuan berriz 3l x 2n = 6n (diatomikoak hauek eer). Amoniakoaren molekulak tetratomikoak dira beraz 2l x 4n = 8n. Hasierako atomo kopurua 2n + 6n izango da, eta bukaerakoa 8n. Atomo kopuruak bere horretan iraun du erreakzioan zehar, beraz, Lavoisierren legea bete da.
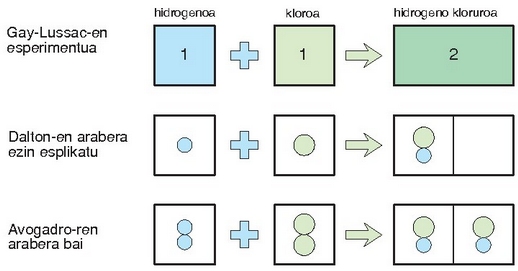
Hidrogeno eta kloro gasen molekulak diatomikoak izan behar dute
Estekiometria
Estekiometria erreakzio kimikoetan parte hartzen duten gaien masak eta bolumenak kalkulatzeko metodoa da (grekeraz stoicheion = lehengaia; metron = neurketa).
Masaren eta bolumenaren kalkuluak errazteko pisu atomiko erlatiboak erabiltzen dira;
hau da, elementu jakin baten pisu atomikoa oinarri harturik kalkulatzen dira gainerakoenak.
Hasieran Daltonek, hidrogeno atomoaren masa hitzarmenez 1 zela eta, elementu hori oinarri hartzea proposatu zuen.
Gaur egun, ordea, jada ez da hidrogenoa erabiltzen oinarri gisa, karbono atomo jakin bat baizik,
karbono 12 esaten zaiona hain zuzen (ik. isotopoak), baina kalkuluak antzekoak dira.
Atomo masak hain txikiak izanik, gure banako edo unitate sistema arruntak erabiliz gero
oso balio txikiak izango genituzke, horrexegatik atomo masen unitatea (AMU) erabiltzen da.
Banako hori hitzarmenez 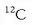 isotopoaren pisuaren hamabirena da. Horrela, adibidez, karbonoaren atomo masa 12 amu izango da, hidrogenoarena 1 amu,
oxigenoarena 16 amu etab.
isotopoaren pisuaren hamabirena da. Horrela, adibidez, karbonoaren atomo masa 12 amu izango da, hidrogenoarena 1 amu,
oxigenoarena 16 amu etab.
Dena dela, erreakzio kimikoetan kalkuluak egiterakoan, ez da eroso izango amu banako edo
unitateak erabiltzea eta horren ordez MOL kontzeptua erabiliko da. Karbonoaren 12 gramotan, hidrogenozko
gramo batean edo oxigenoaren 16 gramotan atomo kopuru bera dago. Kopuru hori
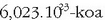 da,
eta Avogadroren omenez Avogadroren zenbakia esaten zaio. Zenbaki honek asko errazten ditu kalkulu kimikoak.
Definizioz, edozer gauzaren mol bat zera da:
da,
eta Avogadroren omenez Avogadroren zenbakia esaten zaio. Zenbaki honek asko errazten ditu kalkulu kimikoak.
Definizioz, edozer gauzaren mol bat zera da:

Substantzia ezbedinen mol bana. Ezkerrean, etanola; erdian, zinka eta, eskuinean, ura
gauza horren 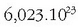 partikula dituen substantzia kantitatea.
Horrela, mol bat karbono 12 gramo karbono badira, mol bat zigarro
partikula dituen substantzia kantitatea.
Horrela, mol bat karbono 12 gramo karbono badira, mol bat zigarro
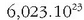 zigarro dituen tabako kopurua izango litzateke, etab. Aipatu beharra dago zehaztu egin behar dela zertaz ari garen:
mol esaterakoan, mol bat atomo, mol bat partikula, mol bat molekula…
zigarro dituen tabako kopurua izango litzateke, etab. Aipatu beharra dago zehaztu egin behar dela zertaz ari garen:
mol esaterakoan, mol bat atomo, mol bat partikula, mol bat molekula…
Bestalde, erreakzio kimikoetan kalkuluak
egiteko ikurrak erabiltzen dira elementuak izendatzeko (adibidez hidrogenoa H, oxigenoa O,....),
eta substantzia bakoitzaren molekulak zenbat atomoz osaturik dauden adierazten da (adibidez hidrogeno diatomikoa
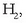 ,
amoniakoa
,
amoniakoa 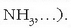 Erreakzioan sarraraziko diren gaiak, hots, erreaktiboak, ezkerraldean idazten dira, eta ematen dituzten
produktuak eskuinaldean; bien artean gezi bat jartzen da eskuinaldera begira. Ponderazio legeak betetzen direla kontuan izanik,
gramo, litro edo beste banako erraz batzuk erabiliz egin ahal izango dira kalkuluak.
Erreakzioan sarraraziko diren gaiak, hots, erreaktiboak, ezkerraldean idazten dira, eta ematen dituzten
produktuak eskuinaldean; bien artean gezi bat jartzen da eskuinaldera begira. Ponderazio legeak betetzen direla kontuan izanik,
gramo, litro edo beste banako erraz batzuk erabiliz egin ahal izango dira kalkuluak.
Masen espektrometroa: atomoen masa neurtzeko gaur erabiltzen den tresna
Gasen dentsitatea: pisu molekularra neurtzen
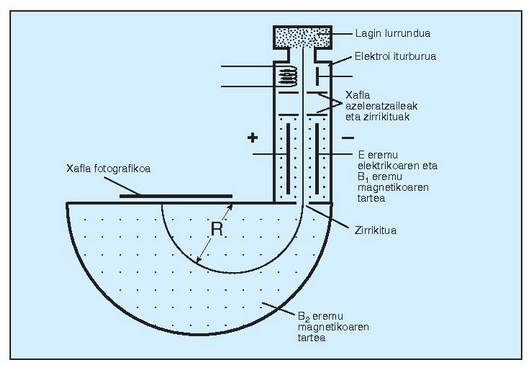
Gasen dentsitatea presioaren eta tenperaturaren araberakoa da (gogoan izan presioak eta tenperaturak gasen bolumenean duten eragina, Boyle eta Gay-Lussacen legeak). Horregatik, dentsitateak konparatu ahal izateko, zein baldintzatan neurtu diren adierazi behar da. Gasen ekuazio ideala erabiliz baldintza jakin batzuetan lorturiko dentsitatea beste edozein baldintzatara pasa daiteke, eta horren arabera, baldintza normalak 0 °C eta 1 atm direla finkatu da hitzarmenez. Dentsitatearekin zerikusia duen beste magnitude bat bolumen molarra da, gasaren mol batek hartzen duen bolumena, alegia. Hori ere zein baldintzatan neurtu den adierazi behar da. Ondoko taula honetan ikus daitekeenez, gas gehienen bolumen molarra, baldintza normaletan (b.n.), 22.4 l inguru da. Hori da gas idealaren bolumen molarra.
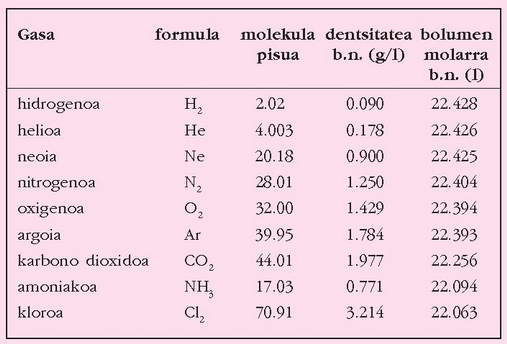
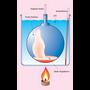
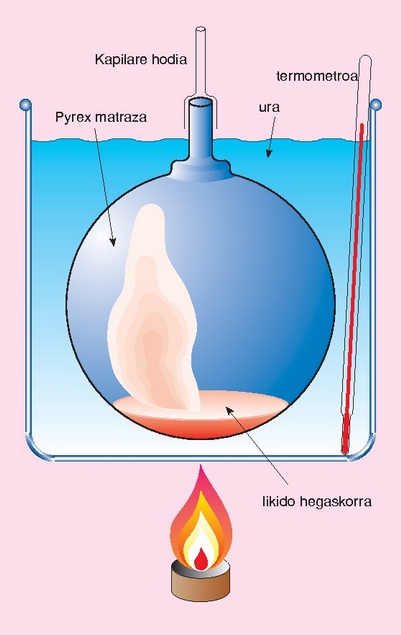
Gas bat presio eta tenperatura baldintza jakinetan pisatuz gero, erraz kalkula daiteke duen pisu molekularra, baldin eta baldintza normaletan bolumen molarra 22.4 l dela onartzen bada. Kalkulu horrek berdin balio du isurkari hegaskorrentzat. Pisu molekularra kalkulatu nahi den isurkariaren irakite puntua 100 °C-tik azpikoa bada, Dumasen metodoa erabil daiteke. Isurkaria matraz batean jarri ondoren (matraza aldez aurretik, hutsik, pisatu behar da), ur irakinetan murgiltzen da; barruko isurkaria lurrintzentzen hasiko da, eta lurrina matrazetik ateratzen. Isurkari guztia lurrindu ondoren, matraza lurrinaz betea egongo da, 100 °C-ko tenperaturan. Gero, matraza uretatik atera, bat-batean hoztu, eta pisatu egiten da. Matrazak hutsik zenbat pisatzen duen badakigunez, erraz kalkula daiteke zenbait pisatzen duen matraz barnean kondentsatuta gelditu den isurkariak (edo 100 °C-tan lurrindurik zegoen gai horrek). Honela bada, 100 °C-tan eta atmosfera baten presioan, lurrinaren pisua kalkulatu da, eta horren arabera kalkula daiteke pisu molekularra.
Pisatu nahi den isurkariaren irakite puntua 100 °C-tik gorakoa bada, ura ez beste isurkari batean murgildu beharko da.
Isotopoak
Atomoak nukleo batez eta zenbait elektroiz osaturik daude. Atomoen nukleoak aldagaitzak dira erreakzio kimiko arruntetan, baina erreakzio nuklearretan, ordea, aldaketak gertatzen dira atomo nukleoaren barruan. Erreakzio nuklear ezagunenak ondorio kaltegarriak dituztenak dira, baina erreakzio nuklear asko eta asko onuragarriak dira bizitzarako: hala nola, adibidez, elektrizitatea sortzeko erabilitzen diren erreakzio nuklearrak, medikuntzan diagnosia egiteko erabiltzen direnak, zenbait eritasunen terapian erabiltzen direnak, eta abar. Nukleo batzuk ezegonkorrak dira, eta berez bilakazen dira beste nukleo batzuetan, elektroiak, positroiak edo beste partikula batzuk askatuz a partikulak askatuz, adibidez). Nukleo horiek nukleo erradiaktiboak dira. Baina nukleo ezegonkorrak ez ezik nukleo egonkorrak ere ezegonkor edo erradiaktibo bihur daitezke, partikula jakin batzuekin bonbardatuz gero a partikulekin, neutroiekin). Elementu bat ezagutzeko bere atomo zenbakia jakin behar da, hots, bere elektroi edo protoi kopurua, baina badira elementu batzuk atomo zenbaki (Z) berbera baina masa zenbaki (A) desberdina dutenak, hau da, neutroi kopuru desberdina dutenak. Elementu horiek elementu isotopoak dira. Elementu baten isotopo batzuk egonkorrak diren bezala, beste batzuk erradiaktiboak izan daitezke. Elementu erradiaktibo batek erreakzio nuklear batean parte hartzen duenean, hainbat partikula klase aska daitezke, a partikulak (izan, heliozko nukleoak dira, baina lehengo izenari eutsi zaio ohituraz), elektroiak (ß partikulak hasiera batean), positroiak (elektroiaren masa bera duen partikula, karga positiboduna)...
Adidibidez, uranioren isotopo 238 U desintegratu egiten da 234 Th bihurtuz; hau elementu erradiaktiboa da oraindik, eta 234 Pa bihurtuz desintegratzen da; Paladio atomo hori ere erradiaktiboa da, eta desintegratu egiten da, 234 U bihurtuz. Desintegrazio kate horiei sail erradiaktibo derizte: 238 U isotopoa, adibidez, 206 Pb isotopo egonkorra bihurtzen da 14 erreakzio nuklearren ondoren. Nukleo erradiaktibo guztiak ez dira ordea abiadura berdinean desintegratzen, baina laginbaten desintegrazio abiadura laginean diren nukleo erradiaktiboen kantitatearen araberakoa izaten da, eta beraz, denbora igaro ahala txikiagotzen da (isotopo erradiaktiboak desagertu ahala). Abiadurarekin zerikusia duen parametro interesgarri bat erdidesintegrazio denbora da. Denbora horrek elementu ezegonkor batek bere intentsitate erradiaktiboaren erdia galtzeko behar den denbora adierazten du, hain zuzen ere. Nukleo batzuetatik besteetara asko aldatzen da parametro hau. Adibidez: 238 U uranio isotopoaren erdidesintegrazio denbora 4,5.10 9 urte da, 222 Ra radon isotopoarena, 3,8 egun, 25 Na sodio isotopoarena, minutu bat.
Desintegrazio erradiaktiboa antzinako gauzakien adina zehazteko erabiltzen da, besteak beste, hau da, fosil, harkaitz edo beste edozein objekturen adina jakiteko. Harrien adina jakiteko, adibidez, 238 U erabili ohi da. Adina jakin nahi den harriaren lagin batean 206 Pb eta 238 U kopuruak neurtzen dira. 238 Uranioaren erdidesintegrazio denbora ezaguturik, 238 U isotopo hori noiztik ari den desintegratzen jakin daiteke, eta hala, desintegrazio hori harria sortu zen unetik beretik gertatzen ari dela onarturik, harria noiz sortu zen jakin daiteke. Metodo hori erabiliz adina kalkulatu zaion lurreko harririk zaharrena orain dela 3.600 milioi urtekoa da. Adina kalkulatzeko beste metodo erradiokimiko bat karbonoaren isotopo 14 C erabiliz egiten dena da. Karbonoaren isotopo hori eguratsean eratzen da izpi kosmikoek nitrogenoa bonbardeatzean. 14 C karbonoaren desintegrazio eta eratze abiadurak konstanteak direnez, gai horren kantitate txiki baina iraunkor bat dago eguratsean, 14 CO2 eran. Landareek CO2 hartzen dute eguratsetik karbohidratoak osatzeko fotosintesian. Beraz, landare eta animalia guztiek dute 14 C kantitate txiki bat ehunetan eta hezurretan. Izaki batek, hiltzen denean, ez du berriz 14 C gehiago barneratzen, eta, beraz, izaki horren karbono kontzentrazioa urritzen hasten da. Hala, beraz, bizirik egondako edozein izakitan 14 C kantitatea neurtuz gero, izakiak hilik zenbat denbora daraman kalkula daiteke.