Fisika-Kimika»Fisika - Kimika
Zientzia. Legeak. Hipotesiak
Zientzia gure mundu fisikoaren ezaguera dela esan daiteke, behar den bezala eratua eta sailkatua. Denboran zehar lortu ahal izan da ezaguera hori eta gizon-emakume askok eta askok hartu dute par - te. Behaketa eta arrazoiketa dira erabili beharreko bitartekoak esandako ezaguera lortzeko. Hasieran, fenomenoak behatu eta ahalik eta zehatzen deskribatu baino ez zen egiten, geroago, behaketak ugariagoak ziren einean, behaketak sailkatu egin ziren, zituzten antzerako bereizgarriak elkartuz; legeak formulatzeko abagunea sortu zen horrela. Lege zientifiko edo natural bat gertaera askoren deskribapena da, modu laburrean egina; sarritan, beste fenomeno batzuetara ere hedatu ahal izango da deskribatutako legea. Legeak, eskuarki, adierazpen matematikoen bidez adierazten dira.
Legea, ordea, ez da izadian gertatzen diren fenomenoen azalpena, deskripzioa baizik. Beraz, ezaguera zientifikoaren bigarren urratsa, legea aurkitu eta gero, azalpenak ematea da hipotesien bidez. Hipotesiek gaitasuna izan behar dute gertakizunak iragartzeko; horrela esperimentalki gertatzen diren gertakizunekin konparatu ahal izango dira, hipotesiaren baliogarritasuna baieztatzeko ala ukatzeko. Hipotesiak iragarria eta gertatutakoa bat baldin badatoz, hipotesia onartu egiten da eta teoria bihurtu dela esango da.
Ezaguera ez da, ordea, izadian gertatzen diren gertakizunen behaketa hutsetik etortzen, gertakizun asko eta asko ez dira izadian gertatzen eta laborategian burutu behar dira; hauek ere hipotesiaren froga izango dira, biak bat badatoz behintzat. Zientziaren jokatzeko modu honi metodo zientifikoa deritza eta bost etapatan laburbil daiteke:
1.- Gertakizunak jasotzea eta biltzea.
2.- Lege orokorrak ematea.
3.- Legeak eta gertakizunak azaltzeko teoriak eta hipotesiak formulatzea.
4.- Teoriak iragarritakoak emaitza esperimentalekin konparatzea.
5.- Gertaera berriak iragartzea.
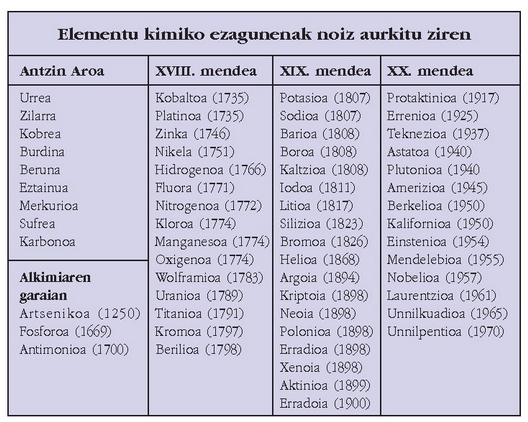
Kimikaren Historia
Kimikaren historia –pentsamendu zientifikoaren garapenean ederrenetariko bat– astiro-astiro, urtez urte, mendez mende jende askoren artean garatutako zientzia baten historia da.
Kimikaren historiaren laburpena egiteko ezinbestekoa da sailkatzea.
Sorrera
Kimikaren sorrera suaren sorrerarekin batera izan zela esan daiteke, berau izan baitzen zalantzarik gabe, gizonak, konturatu gabe izanik ere, erabili zuen lehenengo erreakzio kimikoa (errekuntza erreakzioa). Aurkitutako garai hartako tresneriek argi eta garbi uzten digute ordurako erabiltzen zela sua.
Aurkitutako gauza gehienak metalezkoak, zeramikazkoak, beirazkoak dira; pigmentuak ere aurkitu izan dira, ehun tindatuak, etab. Metalak lortzea, zeramikazko edo beirazko materialak egitea, pigmentuak landareetatik edo mineraletatik ateratzea, lurrinak eta kosmetikoak gertatzea, gorpuak momifikatzea, etab.; horiexek dira hasierako gizonak Kimikaz zituen lehenengo ezaguerak.
Material horien artean gizakiak aurrena erabiltzen ikasi zituenak metalak izan ziren, zalantzarik gabe; material gogorrak ziren, iraunkorrak, forma ematen errazak eta gauzak egiteko aukera handiak ematen zituztenak. Hauen artean eta kronologiaren arabera, urrea, zilarra, brontzea eta burdina aipa daitezke.
Dauden objeturik aspaldikoenak urrezkoak dira, k.a. 5000 urtearen ingurukoak. Arrazoi bat oso oinarrizkoa dago urrearen erabilpen hain goiztarra ondo azaltzen duena: izadian aske aurkitzen da. Bere koloreagatik, duen iraunkortasunagatik eta urria delako, betidanik izan da urrea asko apreziatu den metala. Urrezko platerean jatea, txinatarrek uste zutenez, nahikoa zen gizakiaren bizitza luzatzeko; urrea zurgatzen bazen betiko bizitza lortuko zen eta gainera ahalmen berezia lortzen zen urreari esker: gizakia bat batean mugi zitekeen leku batetik bestera.
Urrea eta zilarra askotan elkarrekin nahastuta egoten dira izadian. Nola bereizte prozesua oso zaila den, aleazioa zen lortzen zena bi metal horiek lantzerakoan. Elektroia esan zitzaion urrezko eta zilarrezko aleazio horri eta urteetan beste metal bat zela uste izan zen.
Urrearekin eta zilarrarekin batera kobrea ere hasi zen erabiltzen. Ez dakigu nola eta noiz isolatu edo bakartu zen lehenengo aldiz metal hau, baina historiako aurkikuntzarik handienetakoa izan zela esaten badugu, ez dugu uste gehiegi esaten ari garenik.
Brontze Aroa K.a.-ko 4000. urtearen inguruan koka daiteke. Ejiptoko lehen dinastien garaian eta Homeroren garaiko Grezian brontzea erabiltzen zen, gaur egun burdina erabiliko litzatekeen lekuetan. Ospe handia izan zuten feniziarrek brontze lanetan; oso bakezaleak izanik ere, beraiek egiten zituzten brontzezko armarik onenak.
Brontzearen garaiaren ondoren Burdin Aroa etorri zen, K.a.-ko 1200. urtearen inguruan. Burdina lortzea eta lantzea zaila eta neketsua zenez, hasieran gutxi erabili bazen ere, garrantzi handiko metala izango zen gero. Burdin Aroan ikasi zen altzairua egiten, garai honetan jakin zen bere gogortasuna tenplearekin hobetzen zela eta saio bat baino gehiago egin zen –arrakastaz askotan– erdoiltzetik babesteko.
Aintzin Aroko zibilizazioen artean ejiptoarrak izan ziren kimikan aurreratuenak eta gaur egungo kimikatik hurbileneko kimika egin zutenak. Benetako maisuak izan ziren beiraren eta esmalteen fabrikazioan; metal nobleen edo errubiaren, zafiroaren eta esmeraldaren imitazio ezin hobeak egiten zituzten. Artilearekin batera asko erabiltzen zituzten larrua, kotoia, lihoa, e.a. ere. Iaiotasun handia azaldu zuten ehunak zuritzen eta tindatzen, eta indigoa eta purpura erabili zituzten tindatzailetzat. Lurrinak, baltsamoak, kosmetikoak, pozoinak, xaboiak eta sodio, potasio, kobre edo aluminio gatzakegiten bazekiten. Betuna ere erabiltzen zuten enbaltsamentuak egiteko eta dekorazioan. Nolanahi ere, guztiz enpirikoak izan ziren aurkikuntza hauek eta ezin esan daiteke zientzia zenik, ezta urrik eman ere.
Greziarrak izan ziren zientzia honetan ejiptoarren ondorengoak eta «chemia» izena eman zioten materia eraldatzeko arteari. Izen hau «chem»-etik omen dator, horrelaxe esaten ziotelako ejiptoarrek bere herriari.
Antzinako doktrina kimikoak
Kristo aurreko 600. urtean greziako filosofoek ondo bereizita zituzten teknika eta erlijioa eta ordurako galdezka hasiak ziren unibertsoa zerez osatua ote zegoen. Aristotele Estagirakoa izan zen filosoforik ezagunena garai horretan (384-322 K.a.); filosofo haren ustez lau substantzia ziren materia guztia osatzen zutenak: lurra, airea, sua eta ura; horiek elkartuz, substantzia guztiak sor zitezkeen baina horretarako beste lau hastapenen laguntza behar zen: beroa, hotza, hezetasuna eta lehortasuna.
Aristotele baino lehenagoko Demokrito Abderakoak (470-380 K.a) materiaren ez jarraitasuna defenditu zuen lehenengo aldiz, eta materia atomoz osatuta zegoela esan zuen, materia zatiezinez, alegia. Atomoak betikoak dira, zatiezinak eta denak izaera berekoak, nahiz eta atomoaren forma, kokapena eta ordena desberdinak diren materialaren arabera. Haren jarraitzaileek ez zuten ideia hori onartu, gaur egungo pentsamoldearekin bat badator ere.
Kristo aurreko 300. urtean Greziako zientzia Alexandriara joan zen eta 400. urtearen inguruan berriz, Erromara. Erromatarrak, gerrari purrukatuak eta eraikitzaile handiak, praktikoak eta estoikoak, ez ziren gai izan grekoek utzitakoari segitzeko.
Alkimia
Ekialdean «chemia» izenez ezagutzen zen zientzia hori arabiarrek ekarri zuten Europara, «kimiya» izenez. Gero, «al» artikulua jarrita, «al kimiya» bihurtu zen –»alkimia» alegia–, eta «kimika» azkenean.
VII. mendean izan zuen alkimiak bere garairik oparoena. Metalak alkimistentzat hiru gairen hastapenen nahastea ziren: merkurioaren metalikotasuna eta hegaskortasuna, sufrearen errekortasuna, eta gatzaren disolbagarritasuna eta sendotasuna. Begibistakoa zen, beraz, metalek hastapen berdinak zituztenez denek, urrea lor zitekeela metaletatik abiatuz.
Alkimisten arabera, metalak urre bihurtzeko filosofia-harria behar zen. Filosofia-harria, beraz, alkimista guztien helburu bihurtu zen, harri hartaz edozein substantzia urre bihurtzeaz gainera, gizakiak betiko gaztetasuna eta edertasuna, eta hilezkortasuna ere lor baitzitzakeen, haren infusioa edanez gero. Ez da harritzekoa beraz, zaharrak, gaixoak eta elbarriak elixir horren bila ibili izana. Jainkoak aukeratuak omen ziren alkimistak, materiaren eraldatzearen sekretuak ezagutzeko, eta sinbolo eta ikur ezezagunen bidez idazten zituzten beren aurkikuntzak. Ez ziren, ordea, beren helburua lortzera iritsi, baina, hala ere, artean ezezagunak ziren produktu askoren berri eman zuten, beste produktu asko lortzeko bideak zabaldu zituzten, aparatu asko diseinatu zuten… Hori guztia oso lagungarria izan zen handik harako ikerkuntzan. Alkimisten artean aipagarriak dira Abu Musa Jabir ibn-Hayyan (Geber izenez ezaguna), San Alberto Magno, San Tomas Akinokoa, Ramon Lull mallorcarra eta Arnaldo Vilanova katalana besteak beste.
Iatrokimika
Metalen transmutazioan sinisteak XIX. mendera arte iraun bazuen ere, Alkimia poliki-poliki bere izaera galtzen joan zen eta hitzjario eta iruzur hutsa bihurtu zen; debekatu ere egin zuten zenbait erregeketa aita santuk. XV. mendean Paracelsusek (1493-1541) alkimiaren helburua gaitzak sendatzeko botikak sortzea izan behar zuela esan zuen. Garai honi –Alkimiaren eta kimikaren trantsiziotzat har daitekeena, bestalde– iatrokimikaren edo kimika medikuaren garaia esaten zaio.
Berpizkundean izadiari eta gorputzen eraldaketari buruzko ideia berriak sortu ziren, eta pixkanaka alde batera utzi ziren alkimisten espekulazioak (filosofia harriarena barne). Kimikak ahaleginak egin zituen gertaerak eta teoria lotzen, kimikariak aurkikuntzak argitaratzen hasi ziren, eta lehenengo Zientzia Akademiak sortu ziren: Napolin (1556), Londresen (1606), Paris (1666), Bartzelona (1764)…
Garai hartakoa zen Robert Boyle irlandar fisikaria eta kimikaria (1627-1691). The Sceptical Chymist liburuan (1661), elementu kimikoaren kontzeptua azaldu zuen, gaur egun ezagutzen den bezala azaldu ere, eta Demokritoren teoria atomikoaz baliatu zen erreakzio kimikoak esplikatzeko.
Lavoisier eta iraultza kimikoa
Aurkikuntza asko ekarri zituzten, zalantzarik gabe, Scheele, Priestey eta Cavendish-en esperientziek, baina flogistoaren teoriaren bidez azalpena ematearekin ondorengo aurrerapena galarazi zuten. Antoine Laurent Lavoisier (1743-1794) izan zen flogistoaren teoria deuseztu zuena, errekuntzaren benetako izaera finkatuz. 1789.ean argitaratuko bere «Tratado elemental de química» delakoan gaur egungo kimikaren oinarriak jarri zituen. 30 urte zituela ondo frogatuta utzi zuen –bere bizitza guztian erabili zuen balantzaren bitartez– errekuntza zer den: erretzen den substantziak airearen osagaietako batekin erreakzionatzearen ondorioa. Ontzi itxi batean eztainua kixkaliz, ontziaren pisua ez zela bat ere aldatu frogatu zuen; metalak pisua hartu bazuen ere, airearena hartu zuelako izan baitzen. Flogistoaren teoria azkenetan dago. Gorputz purua zer den zehaztu zuen, Boyle-ren elementu kontzeptua bereganatu zuen, uraren konposizioa aurkitu zuen eta hidrogeno hitza erabili zuen lehen aldiz, aurretik Cavendishek aire errekorra deitu zuen substantzia izendatzeko.
Bere ikerkuntza guztietan materiaren iraunkortasunaren legea erabili zuen.
Ez dago zehatz esaterik noiz hasi zen kimika zientzia gisa, baina bada ekintza bat, kimikaren abiagunetzat hartzen dena: materiaren iraunkortasunaren legea hain zuzen, Lavoiserrena. Esperimentuz lortu izana da meriturik handiena; lehenengo aldia zen kimika lege bat neurriak erabiliz lortzen zena. Ikerkuntza zientifikoa kimika alorrean orduan hasi zela esan daiteke.
Materiaren sailkapena
Bada zenbait adigai ezin defini daitekeena; materia da horietariko bat. Denon buruan argi dago ordea materia zer den: uki daitekeen zerbait da materia, alegia bolumena eta masa duen oro.
Ez dira, dena dela, masa eta materia kontzeptuak nahastu behar. Masa berdina duten bi gorputz ez daude nahitaez materia berdinez osaturik.
Materia konplexua da oso. Hamaikatxo adibide jar daiteke: arrokak, ibaiak, eguratsa, izaki bizidunen osagaiak, landareak, gizakion gorputza bera, eta abar, materiaz osaturik daude. Materia ikertzeko, beste edozein gai aztertzeko bezala, materia bere ezaugarrien arabera sailkatzea komeni da. Ezaugarri edo tasun horiek fisikoak edo kimikoak izan daitezke.
Ezaugarri kimikoak
Materiaren tasun kimikoak eraldatze prozesuekin daude lotuta. Horregatik, erreakzio edo prozesu kimikoetan definitzen dira. Substantzia kimiko baten aurrean portaera berdina duten substantziak sail batean jarriko ditugu. Zinkak eta sodioak, esate baterako, eta beste zenbait metalek ere, portaera berdina dute azido baten aurrean: hidrogenoa ematen dute; eta oxigenoarekin nahastuz gero, oxidoak ematen dituzte denek. Metal horiek guztiak, beraz, sail batean jarriko lirateke, eta sailkapena haien propietate kimikoak kontuan hartuz egin dela esango litzateke. Elementuen artean badaude batzuk hidrogenoa ematen dutenak urarekin erreakzionatzerakoan: litioa, sodioa, potasioa eta errubidioa, adibidez. Elementu multzo hau alkaliarren sailean edo taldean sartuko genuke, lehen aipaturiko propietate kimikoez gainera beste batzuk ere badituztelako, gorago sodioarentzat aipaturikoak, adibidez.
Ezaugarri fisikoak
Materian aldatu gabe irauten dutelako deitzen zaie horrela tasun horiei. Dentsitatea, likatasuna, lurrin presioa, fusio eta irakite tenperaturak… dira gaien tasun fisikoetariko batzuk. Gasak –nitrogenoa, hidrogenoa, oxigenoa, kloroa…– dentsitate txikiko gaiak dira. Solidoak eta isurkariak edo likidoak, berriz, dentsitate handikoak: osmioa, merkurioa, burdina… Gai horien dentsitatea 10 3 aldiz da gasena. Geologian adibidez, gaiak gogortasunaren arabera ere sailkatzen dira. Azken batean, jakintza arlo bakoitzak bere sailkatze modua du, eta bata edo bestea erabiliko du, zer behar duen.
Materia lehen une batean itxurari begiratuz sailka daiteke. Berdinberdina ikusten bada materia hori alderdi guztietan, orduan materia hori homogeneoa dela esango da. Berdin-berdina ikusten ez denean, ostera, materia heterogeneoa dela esango da.
Materia homogeneoa
Materia zati batek osaera eta itxura berdina dituenean alderdi guztietan, homogeneoa dela esaten da. Materia homogeneo horri, zenbait osagaiz eratua badago, disoluzio esaten zaio, eta osagai bakarraz eratua badago, substantzia puru.
Disoluzioa. Zenbait osagaiz eraturiko materia homogeneoari esaten zaio disoluzio. Osagai horiek desberdinak izan daitezke, eta metodo fisikoen bidez bereiz daitezke. Disoluzioaren ezaugarriak multzo osoarenak dira, ez osagaienak. Gatza uretan disolbatuz gero, beraz, disoluzio bat lortzen da, disoluzio isurkari bat –gatza solidoa bada ere–, eta gazia –ura zapore gabea bada ere–. Disoluzio

Masa magnitude estentsiboa da, eta tenperatura berriz, intentsiboa. Argazkian erlenmeyer banatan kobre sulfatozko bi disoluzio berdin ikus daitezke. Masa ezberdina dute biek, baina tenperatura berdin-berdina da.

horren lagin desberdinak hartuta ere, ezaugarri berdinak izango dituzte denek. Hau da, ezin izango dugu gatz zapore gabeko materiarik hartu, ezta isurkari ez denik ere. Beste horrenbeste esan daiteke dentsitateaz (edo trinkotasunaz), irakite tenperaturaz…
Substantzia puruak. Substantzia puruek konposizio berdina dute beti. Itsas ur destilatuak, euri urak edo hostoetakoak, tasun berberak ditu beti, eta konposizio berbera. Urak beti izango du hidrogeno eta oxigeno proportzio berbera (2 g hidrogenoko 16 g oxigeno), beti irakite tenperatura bera (100 o C), fusio tenperatura bera (0 °C), eta abar. Substantzia puru gehienak konposatuak dira, eta deskonposatzean elementuak ematen dituzte. Konposatuak formula kimikoen bidez adierazten dira, gaia osatzen duten elementuak eta horien proportzioa adieraziz. Hiru bat miloi konposatu ezagutzen dira gaur egun.
Substantzia sinpleetan ezin deskonposa daitezkeen substantziak elementu kimikoak dira. 106 elementu daude guztira, eta horietarik 90 besterik ez dira izadian; beste guztiak laboratorioan eginak dira, eta interes zientifiko hutsa dute. Elementuak sinboloen bidez adierazten dira eta haiek sailkatzeko taula periodikoa deritzona erabiltzen da. Substantzia puruek, konposatuak ala sinpleak izan, beste substantzia batzuk izaten dituzte (zikinak), kantitate txikitan bada ere. Beraz, substantzia bat, oso zikin gutxi duenean, substantzia purua dela esaten da.
Materia heterogeneoa
Bi substantzia puru edo gehiagoz osaturiko materiari heterogeneo deritzo. Materia heterogeneoak ez ditu propietate edo tasun berdinak alderdi guztietan. Granito puska batean, adibidez, erraz bereiz daitezke tasun ezberdineko alderdiak: beltzak, arrosak eta zuri gardenak. Alderdi horiek kolorea ez ezik beste tasun guztiak ere ezberdinak dituzte: dentsitatea, gogortasuna, fusio tenperatura… Adibide ezagun bat uraren eta olioaren nahaste heterogeneoa da. Horretan ere alderdi ezberdinak ikus daitezke, bi alderdi hain zuzen, bata ura eta bestea, uraren gainean, olioa. Materia banatua dagoen zati heterogeneoetako bakoitzari fase esaten zaio. Fase bakoitzak bere tasunak ditu: dentsitatea, konposizioa, kolorea, eta abar. Olioa eta ura nahasten ahaleginduz gero, bi fase lortuko dira eta bi substantziak nahastezinak direla ikusiko da. Materia hori heterogeneoa da, baina fase bakoitza, aldiz, homogeneoa. Olioak, adibidez, (izan, ez da olio purua, olioa ur pixka-pixka batekin baizik) kolore jakin bat du, dentsitate jakin bat, eta abar, eta ezaugarri horiek berdinak dira fase horren alderdi guztietan. Beste faseak, urak alegia, beste propietate batzuk ditu, berdinak fasearen alderdi guztietan.


KIMIKAREN ZENBAIT ARLO
Kimika organikoa: Karbonoa duten konposatu naturalen edo sintetikoen azterketaz arduratzen da. Horregatik, karbonoaren kimika ere deitzen zaio. Karbonoa ez ezik nitrogenoa, oxigenoa, sufrea, fosforoa, halogenoak… ere izan dezakete. Elementu horiek lotura kobalenteen bidez elkartzen dira karbonoarekin.
Industria kimika: Kimikaren beste adar batzuetako aurkikuntzak industrian nola erabili aztertzen du: laboratorioan lortutako erreakzioak handizka nola egin, esate baterako, produktu bat kantitate handitan eta ahalik eta merkeen ekoiztu ahal izateko.
Kimika ez-organikoa: Karbonorik ez duten konposatu naturalen eta sintetikoen ikerketaz arduratzen da. Zenbait konposatu hala ere, karbonoa izan arren ez-organikotzat hartzen dira, karbonatoak adibidez. Kimika ez-organikoa deskriptiboa da, sintetikoa eta fisikoa.
Materialen zientzia: Material ezagunen tasun fisikoak eta kimikoak aztertzen ditu. Material berriak lortzea ere bada zientzia honen helburu, erabilera jakinetarako materiala sortzea, hain zuzen.
Koloideen kimika: Koloideen prestakuntzaz eta beren tasunak ikertzeaz arduratzen da. Koloideetan fase jarrai batean partikula multzo bat barreiatzen da. Partikulak molekulak baino askoz handiagoak dira, baina ez mikroskopioz ikusi ahal izateko adina.
Farmakologia: Drogek animalia bizietan duten eragina aztergai duen medikuntzaren alorra da farmakologia.
Elikagaien zientzia: Elikagaien ikerketa kimikoa egiteaz arduratzen da, eta alderdi asko hartzen ditu kontuan: dietetika, nutrizioa, prestakuntza eta kontserbazioa…
Ingenieritza kimikoa: Industria kimikoan erabili ohi diren makineriaren erabileraz, fabrikazioaz eta diseinuaz arduratzen da. Adibidez, ontziek, hodiek eta abarrek, hainbat produkturen ekintza – azidoak, gas pozoitsuak, disolbatzaile hegaskorrak…–, eta lantegietako tenperatura eta presio garaiak jasateko modukoak izan behar dute.
Elektrokimika: Erreakzio kimikoen ondoriozko energia elektrikoaren sorrera edo alderantziz, korronte elektriko batek eragin ditzakeen erreakzio kimikoak, aztergai dituen kimikaren alorra da elektrokimika. Elektrolisia ere –alegia, elektrolitoak dituen disoluzio batetik korronte elektrikoa igaroaraziz egiten den deskonposatze kimikoa– alor horretan sartzen da. Berez (gatz urtuek) edo disoluzioan daudenean (azido, gatz edo base soluzioak) korronte elektrikoareneraginez ioietan deskonposatzeko tasuna edo propietatea duen gorputza da elektrolitoa.
Fisikokimika: Gaien tasunetan egiturak izan ditzakeen eraginen ikerketa. Fisikaren hastapenak erabili ohi dira portaera kimikoa aztertzeko. Hauen artean termodinamika kimikoa dago, tenperaturak eta presioak erreakzio kimikoetan izan ditzaketen eraginak aztertzen dituen alorra.
Espektroskopia: Gorputz batek xurgatu edo igorririko erradiazio elektromagnetikoaren espektroa aztertzen du espektroskopiak. Substantzia sinple edo konposatuen egiturari eta nahastearen osagaiei buruzko informazioa ematen du.
Biokimika: Izaki bizidunen kimikaren ikerketa egiten da alor honetan, batez ere izakion osagai kimikoen gainean eta horien artean gertatzen diren erreakzioetan. Fisiologia, nutrizio eta genetikaren zati handi bat hartzen du biokimikak, eta eragin handia du medikuntzan, nekazaritzan eta industrian.
Kimika teorikoa: Elementuen portaera eta tasunak aurkitzeko atomo mailan aztertu behar dira gai horiek, batez ere aztertu behar dena da elektroien portaera kimika loturetan.
Kromatografia: Isurkari edo gas egoeran dauden nahasteetako osagaiak bereizi daitezke kromatografiaren bidez. Pisu molekularraren arabera ere bereiz daitezke zenbaitetan substantzia horiek. Paper kromatografia, gas kromatografia eta geruza meheko kromatografia aipa daitezke kromatografia metodoen artean.
Fotokimika: Erreakzio fotokimikoak aztertzen dituen kimikaren alorra da. Erreakzio fotokimikoak argiaren eraginez gertatutako erreakzioak dira. Lehenengo, argia xurgatzen du atomo batek, molekula batek edo lotura batek. Partikula kitzikaturik, erreakzioa sortuko da. Fotosintesian eta argazkilaritzan gertatzen diren erreakzioak fotokimika erreakzioak dira.
Kimika analitikoa: Substantziak identifikatzen dira kualitatiboki eta kuantitatiboki, hau da, zer substantzia dauden lagin batean eta zer kopuru bakoitzetik. Hori jakiteko metodo fisikoak eta kimikoak erabiltzen ditu kimika analitikoak.
Taula periodikoa: Taula periodikoa gai bakunen sailkapen bat da, atomo zenbakiaren arabera egindakoa, hain zuzen. Egiturak ere azaltzen dira eta gai ezberdinen erlazio kimikoak. Zutabeak taldeak dira eta lerroak periodoak.
Elementuak eta molekulak
Atomoen egitura ezagutzea ezinbestekoa da gertaera kimikoak azaltzeko. Izan ere, prozesu kimiko guztietan, aldaketak gertatzen dira gunean. Substantzia kimiko guztiak, adibidez, atomoko elektroien elkar ekintzaz sortu dira. Atomoak, beraz, beste –bera bezalako edo bestelako– atomo batzuekin elkartzen dira substantzia konposatuak emateko. Substantzia sinple batean atomo guztiek ezaugarri berdinak dituzte, baina atomoek desberdin jokatzen dute gai batean edo bestean, beraien arteko elkar ekintzak desberdinak dira, alegia. Horregatik dituzte gaiek hain propietate ezberdinak. Helioaren fusio tenperatura, adibidez, -272 °C-koa da, ahulak baitira helioaren atomoen arteko elkar ekintza indarrak. Aitzitik, diamantearen fusio tenperatura 3.500 °C-koa da, atomoak estu-estu, indar handiz lotuta daudelako elkarrekin.
Atomoak elkarrekin lotzen direnean molekulak sortzen dira. Hau da, kimika loturez elkarturiko atomo multzoak dira molekulak. Nitrogeno, oxigeno eta kloro molekulak, adibidez, elementu horien bina atomoz osatuta daude. Horregatik, molekula diatomiko esaten zaie. Baina badira atomo gehiagoz eratutako molekulak ere:
sufre molekula, adibidez, 8 atomoz osatua dago. Bestalde, elementu bakoitzaren atomo eta molekula osaera adierazteko formulak erabiltzen dira, hau da, zenbakiez eta gaien laburdurez osaturiko sinbolo multzoak.
Gai elkartuak (konposatuak)
Molekula bat elementu desberdinen atomoz osatua ere izan daiteke. Gai elkartuen molekulak dira horiek. Molekula horiek, substantzia sinpleen molekulak bezala, formulen bidez adierazten dira. Formula kimikoen atomoak sinboloen bidez adierazten dira eta beren proportzioa, zenbakien bidez. Uraren molekula, adibidez, oxigeno atomo batez eta bi hidrogeno atomoz osaturik dago: H O 2 du formula. Gatz arruntaren molekula sodio eta kloro atomo banaz osatua dago: formula, beraz, NaCl du.
Gai elkartu baten molekulak berdin-berdinak dira eta beren portaera kimikoa ere berdina izango da. Kimikari dagokionez, beraz, bi ur tanta berdin-berdinak dira beti, ur hori itsas ur edo euri ur izan… Uraren konposizioa eta, beraz, formula ere berdin-berdina da (H2O) ura izotz egoeran izan, isurkari egoeran izan edo lurrin egoeran izan.


