Izadi Jakintza»Izadi jakintza
Gatz mineralak ingurune organikoan: disoluzioak
LABURPENA: Gatz mineralak bi egoera desberdinetan izaten dituzte izaki biziek:
egoera gotorrean eta disoluzio egoeran. Organismoentzako garrantzitsuenak disoluzioen
parte diren gatzak dira, organismoaren barne orekan zeresan handia duten zenbait
gertaeraren erantzule baitira, gertaera osmotikoen eta pHaren aldaketen eragile hain
zuzen. Era berean, suspentsio koloidal edo koloide deritzatenetan ere parte hartzen dute
gatzek, sarritan egoten baitira egoera horretan molekula organiko handiak.Gatzak ezinbestekoak dira bizitzan.
Kimika gai hauen garrantzia agertzeko abiapuntu egokia izan daiteke zibilizazioen historia gogoratzea. Ondo ezaguna da gatzaren komertzioa Saharako basamortuan zehar, harri eta hondar eremu izugarriak igarotzen zirenean mineral preziatu hura garraitzeko; hain zen gatza garrantzitsua, non beduinoek gatz puskak erabiltzen baitzituzten diru gisa Saharaz behetiko afrikar leinuekiko harremanetan.
Ez dago hain urrutira joan beharrik gatzen garrantzi handiaz ohartzeko. Behizain eta artzainek gatz puska handiak ematen dizkiete zaintzen (zelai itxi edo ukuiluetan) dituzten animaliei. Animalia basatiak edo erdi basatiak (mendiko zelaietan libre), beren beharrak asetzeko, gatzak dauzkaten harrien bila ibiltzen dira; hala, oso erraz aurkitzen dira mendian-eta harri guztiz leunduak, behin eta berriz miazkatuak.
Gai hauen garrantziaren zergatiaz jabetzeko gatzen nolakotasun kimikoaren alderdi batzuk ezagutzea komeni da, era horretan galdera oinarrizkoenari erantzun ahal izateko: zer da gatz bat? Azido bat eta base bat elkarrekin konbinatzen direnean, azidoaren  ak basearen
ak basearen  arekin erreakzionatzen du, eta ur molekula bat eratzen. Azidoaren gainerako partea (anioia) basearen gainerako partearekin konbinatzen da (katioiarekin), eta gatz bat eratzen da. Gatzetan "arruntena" den eraketa erreakzioa izan daiteke horren adibide argia, alegia, sukaldeko gatzarena:
arekin erreakzionatzen du, eta ur molekula bat eratzen. Azidoaren gainerako partea (anioia) basearen gainerako partearekin konbinatzen da (katioiarekin), eta gatz bat eratzen da. Gatzetan "arruntena" den eraketa erreakzioa izan daiteke horren adibide argia, alegia, sukaldeko gatzarena: Izan ere, gatza oso kontzeptu zabala da, bi
ioiren elkarketak osaturiko gai kopuru
handi bat bere baitan hartzen duena. Ioi
loturaz daude elkartuak bi osagaiak, eta,
hortaz, gai horiek, ioi hidratatuak osatzen
direnean, oso disolbagarriak izaten dira uretan.
Izan ere, gatza oso kontzeptu zabala da, bi
ioiren elkarketak osaturiko gai kopuru
handi bat bere baitan hartzen duena. Ioi
loturaz daude elkartuak bi osagaiak, eta,
hortaz, gai horiek, ioi hidratatuak osatzen
direnean, oso disolbagarriak izaten dira uretan.
Disolbagarritasunak gatzen lehen sailkapen
bat egiteko balio du, organismoan
dauden egoeraren arabera:
- Gatz disolbaezinak (“forma konbinatukoak”
ere esaten zaie). Kasu honetan
gatzak ez daude disolbaturik, hau da, ur
ingurune organiko batean egon arren, ez
dira dagozkien ioi hidratatuak eratzen.
Talde honen barruan bereziki garrantzitsuak
dira karbonatoak (oso disolbagarritasun
apala duten gatz bakarretako bat),izaki bizi askok dauzkaten maskorrak,
oskolak, eta beste eskeleto egitura edo
babes egitura batzuk.
Fosfatoek ere garrantzi handia dute, oso
ugariak baitira hezur ehunaren zelula arteko
gaian (kaltzio fosfatoa).
Heriotzaren ondoren fosilak sorrarazten
dituzten prozesuetan, bi gatz mota hauek
ordezkatzen dute materia organikoa.
Gatz hauek ez baitaude izaki bizi guztietan,
ez da pentsatzen “balio unibertsala”
dutenik, hots, ez dira bizitzarako ezinbesteko
gaiak.
- Gatz disolbagarriak (“forma disoziatu”
ere esaten zaie). Disoluzioan azaltzen dira,
anioi eta katioietan banatuak (1. irudia). Gatz hauei esentzial esaten zaie, oso garrantzi handiko eginkizunak betetzen baitituzte organismoen barruan. Izan ere, ioi moduan betetzen dituzte beren eginkizunak bioelementu sekundario eta oligoelementu askok.
Gatz hauei esentzial esaten zaie, oso garrantzi handiko eginkizunak betetzen baitituzte organismoen barruan. Izan ere, ioi moduan betetzen dituzte beren eginkizunak bioelementu sekundario eta oligoelementu askok.
Horrez gainera, izaki bizien barneko jariakarietan ia guztiz konstante mantendu beharra dauka ioi hauen kontzentrazioak. Hala, ezin da esan izaki bizien barruan ura dagoenik, "jariakariak" baizik, edo gatzen eta beste gaien uretako disoluzioak; horiexek osatzen dute barne ingurunea deritzana.
Barne inguruneak, ioi disolbatuen kontzentrazioari edo kopuruari dagokionez, beti bera edo bertsua izan behar du. Kaltzio katioiaren
Disoluzioak
Organismoen barne inguruneak ur kopuru handiak dauzka, eta ingurune horretan gertatzen dira metabolismoaren erreakzio gehientsuak; argi adierazten du horrek zer nolako garrantzia duten disoluzioek izaki bizietan.
Hala ere, eguneroko hizkeran, gaizki erabiltzen da maiz “disoluzio” hitza, molekula barreiatu sail bat (solutua) uretan (barreiahautsatzaile edo disolbatzailean) agertzen den guztietan
erabiltzen baita. Ideia honen norainokoaz
jabetzeko, komeni da gogoratzea urarekin
konbinatzeko zenbait gaik dituzten
posibilitateak.
- Gotor-isurkari: kasu honetan, gerta daiteke
bi gai elkarrekin nahastu eta handik denbora
puska batera berriz ere banatzea (hauspeatzea),
eta, kasu horretan, suspentsioa dela
esango dugu. Hala, sendagai askorekin suspentsio
bat prestatu behar izaten da, antibiotiko
hautsa ur kopuru jakin batean “disolbatuz”;
alabaina, denbora puska baten ondoren,berriz ere behean dagoela ikusiko da, eta, hori dela-eta, argibideetan beti azpimarratzen da: “astindu erabili aurretik”.
Disolbatzaile gisa jokatzen duen solutua eta ura konbinaturik egonkor mantentzen badira, bi egoera desberdin gerta daitezke: + Solutuaren molekulak txikiak izatea tamainaz, gatzetatik abiaturik ioi hidratatuekin gertatzen den bezala. Kasu honetan benetako disoluzioa da. Disoluzioak ur garbiaren itxura hartzen du; argitara jarrita ere ezin dira molekulak eta solutua bereizi, eta hori gertatzen da ioitan banatuak daudelako, atomo bakar batek osaturik (adibidez,  ), edo haien talde txiki batek (
), edo haien talde txiki batek ( ren kasuan bezala).
ren kasuan bezala).
+ Tamainaz oso handiak izatea solutuaren molekulak. Hau da, gai normalean organikoak dira, atomoak lotura kobalentez elkartuak dituztenak, baina atomo talde polarrak dauzkatenak (ioitu daitezkeenak, adibidez, - COOH edo 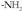 ). Ur molekulek bipolaritatearen tasuna dute, eta, horregatik, talde ioituak inguratu egiten dituzte ioituak daudenean, eta molekulak elkarrengandik banaturik mantentzen dituzte; era horretan molekulak isurkarian sakabanaturik egonkor egoten dira (3. irudia). Egoera honi, oro har, barreiadura koloidal esaten zaio.
). Ur molekulek bipolaritatearen tasuna dute, eta, horregatik, talde ioituak inguratu egiten dituzte ioituak daudenean, eta molekulak elkarrengandik banaturik mantentzen dituzte; era horretan molekulak isurkarian sakabanaturik egonkor egoten dira (3. irudia). Egoera honi, oro har, barreiadura koloidal esaten zaio.
- Isurkaria-isurkaria: argi dagoenez, bi isurkari nahastezin nahastea da gauza, zeren, bestela, nahastu egiten baitira, eta diluzio bat sortzen dute; hala adibidez, alkohola (eta edari alkoholdun batzuk, legez kanpoko manipulazioetan), uretan diluitzen da.
Lehen bezala, gerta daiteke aldi batez nahastuta egon ondoren bi gaiak banatzea.
Kasu honi emultsio esaten zaio. Halaxe gertatzen da urarekin eta ozpinarekin; irits daitezke nahastera, baina denbora pasa ahala bi
geruza desberdin sortzen dira.
Aitzitik, denborarekin banatzen ez badira
emultsio koloidala sortzen da. Kasu honetan,
isurkarietako bat hidrofoboa da, eta lotura
hidrofobiko bidez taldekatzen dira bere
molekulak, mizela izeneko molekula sailetan.
Larruazala hidratatzeko krema da
horrelako nahasketaren adibide bat, eskuak
zaintzeko erabiltzen dena adibidez, zeinak
gai koipetsuak dauzkan uretan beti suspentsioan
(horregatik “hidratatzen” du azala).
Orain arte deskribatu diren kasu guztien
artean, benetako disoluzioak eta barreiadura
koloidalak dira garrantzitsuenak izaki bizietan.
Disoluzioen eginkizuna organismoetan
Disoluzioen garrantzia ulertzeko, materiaren egoera honi loturiko hiru tasun ulertu behar dira: difusioa, osmosia eta ingurunearen erreaktibitatea edo pHa.- Difusioa: Laburtzeko, esan daiteke prozesu honetan disolbatzailearen bolumen guztira hedatzeko joera dutela solutuaren zatikiek, harik eta kontzentrazio homogenoa lortzen duten arte.
Solutua kontzentrazio handiena dagoen lekuetatik kontzentrazio txikienekoraino zabaltzen da (4. irudia). Hori gertatzen da, adibidez, urez beteriko ontzi batean merkromina tanta bat jartzen denean; hasieran, erortzen den puntutik gertu bakarrik barreiatzen da tanta, eta kolore gorri iluna hartzen du inguru horrek; denbora pasatzen uzten bada, arroxa antzeko kolorea hartzen du ontzi osoak, merkromina era homogeneoan banatu delako.
Difusio prozesuak garrantzi handia du zelularen jardunean; izan ere, difusioari esker truka daitezke gai neurriz txikiak zelularenlaren eta kanpoko ingurunearen artean (adibidez,
oxigenoa eta anhidrido karbonikoa).
Organismo konplexuetan, eta baita ekosisteman
ere, garrantzitsua da; izan ere, atmosfera
ukitzen duen aire geruzako oxigenoa,
difusio prozesu batez, itsasoko eta ibaietako
uretan disolbatzen da. - Osmosia: Prozesu hau gertatzen da bi parte banatuta geratzen direnean mintz erdi irazkor deritzanaren bidez; disolbatzailearen molekulak pasatzen uzten dituen mintza da, baina ez solutuarenak. Mota honetakoak dira izaki bizietan zelula mintzak.
- Osmosia: Prozesu hau gertatzen da bi parte banatuta geratzen direnean mintz erdi irazkor deritzanaren bidez; disolbatzailearen molekulak pasatzen uzten dituen mintza da, baina ez solutuarenak. Mota honetakoak dira izaki bizietan zelula mintzak.
Mintzak daudelako, solutuaren kontzentrazioa txikiena den partetik (solutu baino ur gehiago dago), solutuaren kontzentrazioa handiagoa den alderantz egiteko joera dute disolbatzailearen molekulek; mintzaren bi aldeetako kontzentrazioak berdintzen direneaneteten da alde batetik besterako mugimendua.
Presio osmotikoari dagokionez, kontzentrazio desberdinak eduki ditzakete mintzak banatzen dituen parteek, eta, kasu horretan, hipertoniko esaten zaio bati (kontzentrazio handienekoari) eta besteari hipotoniko (kontzentrazio gutxienekoari); berdin-berdinak ere izan daitezke kontzentrazioak, eta kasu horretan isotoniko esaten zaie (5. irudia). Erdi irazkorra izanik zelula mintza, zelulaz kanpokoari buruz, hiru egoera posibleetako batean egongo da zelula arteko ingurunea:
+ Zelula soluzio hipertonikoan egotea. Hau da, zelula barneko ingurunea isotonikoa da kanpokoari buruz. Kasu honetan, urak zelula barnetik ateratzeko joera izango du, kontzentrazioak berdintzeko, eta, hala, uzkurtzean, bolumena galduko du zelulak. Landare zeluletan aztertu da hau: plasmolisi izeneko prozesu batez, zelula paretaren mintza banatu egiten da (zurrunagoa izanik,
ez du forma galtzen).
Erdi irazkorra izanik zelula mintza, zelulaz kanpokoari buruz, hiru egoera posibleetako batean egongo da zelula arteko ingurunea:
+ Zelula soluzio hipertonikoan egotea. Hau da, zelula barneko ingurunea isotonikoa da kanpokoari buruz. Kasu honetan, urak zelula barnetik ateratzeko joera izango du, kontzentrazioak berdintzeko, eta, hala, uzkurtzean, bolumena galduko du zelulak. Landare zeluletan aztertu da hau: plasmolisi izeneko prozesu batez, zelula paretaren mintza banatu egiten da (zurrunagoa izanik,
ez du forma galtzen).
Gai biologikoak ingurune hipertonikoetan ipintzea antzinatik egiten den gauza da. Hala, pieza freskoak aldi batez gatzetan sartzea izaten da urdaiazpikoak ontzeko lehen urratsa, eta, horrela, ura galtzen dute (eta, hortaz, nekezago jarduten dira mikroorganismoak), eta ohiko gogortasuna hartzen du
haragiak.
+ Zelula soluzio hipotonikoan dago. Hori dela-eta, kontzentratuagoa dago zelula arteko ingurunea kanpokoa baino, eta zelulan sartzera jotzen du urak. Ura sartzeak hanpatu egiten du zelula, eta hautsi ere egin daiteke azkenean.
Sukaldeko biologiara itzulita, adibide ona dira lekariak, beratzen jartzen direnean; edobakailao lehorra, hori ere beratu egiten baita
jan aurretik. Kasu batean zein bestean, urez
betetzen dira zelulak, eta, horren ondorioz,
bigundu egiten da janaria.
+ Zelula ingurune isotonikoan egotea, hau
da, kontzentrazioa kanpokoaren berdina izatea.
Kasu honetan, ura ez da ez sartzen, ez ateratzen.
Hauxe da giro egokiena, eta, horregatik,
organismoen barne inguruneak beti bera
mantendu behar du gatzen kontzentrazioa,
hartan bizi diren zeluletan fenomeno osmotiko
kaltegarriak gutxiago izan daitezen.
Osmosiarekin zerikusia duten arazoek ere
eragozten dute itsas organismo asko ur gezatan
bizitzea. Horixe ikusten da, adibidez,
hondartzan harrapatutako animaliaren bat
bizirik eduki nahian iturriko urez betetako
ontzi batean sartzen denean; aldi bat igarota,
hil egiten da. Normalean gorpua muki
moduko batez inguraturik agertzen da,
parte batez lehertutako zelulen edukitik
datorrena, eta baita animaliak berak isurtzen
dituen gai mukitsuetatik ere, bere ehunek
uraren bat-bateko sarrera eragotzi nahiz.- pHa: Ingurune jakin baten erreaktibitate maila adierazten du, hau da, azidoa edo basikoa den ingurunea. Horretarako ur garbia hartzen da erreferentzia gisa, neutrotzat hartzen baita.
Formula honen arabera definitzen da pHa: Formula hori urari aplikatzean, kontuan izan behar da ioitze gradu guztiz apala duela, eta, horren ondorioz, litroko
Formula hori urari aplikatzean, kontuan izan behar da ioitze gradu guztiz apala duela, eta, horren ondorioz, litroko molekula besterik ez dela izaten egoera horretan, eta horrek, oreka kimikoaren legeen arabera, ondoko ekuazio hauetan laburtzen den disoziazio konstantea ematen du:
molekula besterik ez dela izaten egoera horretan, eta horrek, oreka kimikoaren legeen arabera, ondoko ekuazio hauetan laburtzen den disoziazio konstantea ematen du: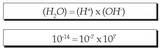 Horren ondorioz, formula hori ur garbiari
aplikatuta, emaitza 7 da, eta balio hori
hartzen da pH neutrotzat (6. irudia).
Horren ondorioz, formula hori ur garbiari
aplikatuta, emaitza 7 da, eta balio hori
hartzen da pH neutrotzat (6. irudia).
Zer gertatzen da urari azido bat, klorhidrikoa
adibidez, eransten zaionean? Ioitu
egiten da; ez da ahaztu behar erabat “disolbatzen”
dela, ondoko erreakzio honen arabera: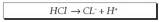 Horrek adierazten duenez, hasierako urak
beste H + bat hartzen du, eta horrekin handitu
egingo da disoziazioaren konstantearen
formulan H + ren kontzentrazioa adieraztenduen zenbakia; hau da, negatibotasuna galduko du, eta
Horrek adierazten duenez, hasierako urak
beste H + bat hartzen du, eta horrekin handitu
egingo da disoziazioaren konstantearen
formulan H + ren kontzentrazioa adieraztenduen zenbakia; hau da, negatibotasuna galduko du, eta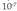 eta 10 arteko balioak hartu ahal izango ditu; horrek, formula aplikatu ondoren, 7 eta 0 arteko pH bat emango du.
eta 10 arteko balioak hartu ahal izango ditu; horrek, formula aplikatu ondoren, 7 eta 0 arteko pH bat emango du.
Base indartsu bat eransten baldin bada, adibidez Na OH (soda), hori ere erabat disolbatzen dela ikusiko da; hortaz, ondoko erreakzio honen arabera ioitzen da: Hau da,
Hau da, 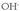 ioiez kargatzen da disoluzioa, eta horrekin kopuruak berak ere negatibotasuna galduko du. Ez da ahaztu behar ordea
ioiez kargatzen da disoluzioa, eta horrekin kopuruak berak ere negatibotasuna galduko du. Ez da ahaztu behar ordea 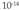 konstante bat dela, hots, aldatzen ez den zenbakia, ekuazioaren beste aldean diren kopuruak gorabehera. Hori horrela izan daiteke baldin eta gutxitzen bada, negatiboago egiten bada alegia,
konstante bat dela, hots, aldatzen ez den zenbakia, ekuazioaren beste aldean diren kopuruak gorabehera. Hori horrela izan daiteke baldin eta gutxitzen bada, negatiboago egiten bada alegia, 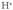 ioi kopurua (azidokoan
ioi kopurua (azidokoan 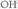 ei eragiten die horrek), eta, hori dela-eta, hidrogenioien
ei eragiten die horrek), eta, hori dela-eta, hidrogenioien  kontzentrazioa
kontzentrazioa  eta
eta 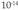 artekoa izango da, edo, gauza bera dena, 7 eta 14 artekoa izango da pHaren balioa.
artekoa izango da, edo, gauza bera dena, 7 eta 14 artekoa izango da pHaren balioa.
Izaki biziek beti bera mantendu behar dute beren barne inguruneko pHa, zeren, bestela balitz, metabolismoaren erreakzio asko ez bailirateke gertatuko, eta erreakzio horietan parte hartzen duten entzima askok ez lukete jardungo. pHak konstante iraun dezan nahitaez gatzek parte hartu behar dute, edo, zehatzago, gatz batzuek, sistemabiguntzaile, tanpoi sistema edo buffer deritzenak eratuz. Gai horiek orekatzaile kimikoak dira; ekuazioaren zein aldetan kokatzen diren, askatu edo beretzen dute ingurunetik, eta pHaren balioa erregulatzen.
askatu edo beretzen dute ingurunetik, eta pHaren balioa erregulatzen.
Zehatzago, tanpoi fosfato sistema izenekoaren bidez erregulatzen da zelulen barneko pHa, ondorengo erreakzioan oinarritzen dena:  pHaren erregulazio sistema, zelulaz kanpoko isurkarian, sistema tanpoi bikarbonatoa delakoak erregulatzen du. Hau da erreakzioa:
pHaren erregulazio sistema, zelulaz kanpoko isurkarian, sistema tanpoi bikarbonatoa delakoak erregulatzen du. Hau da erreakzioa: Karbono azidoa
Karbono azidoa ez da batere egonkorra; berehala deskonposatzen da, eta karbono anhidridoa eta ura ematen ditu.
ez da batere egonkorra; berehala deskonposatzen da, eta karbono anhidridoa eta ura ematen ditu.
Koloide organikoak eta gatzak
Disoluzio koloidalek izugarrizko garrantzia dute organismoetan; izan ere, isurkari organiko gehienek makromolekulak edukitzen dituzte suspentsioan, eta, hori dela-eta, suspentsio koloidalak izaten dira. Zitoplasma bera, adibidez, suspentsio koloidala da. Ez da harritzekoa, pentsatzen baldin bada itsaso primitiboak, bizitza agertu aurretik, molekula organiko handiak besterik ez zirela, ur gazietanbarreiatuak; hortaz, zelula horien edukia “lehen zopa” delako haren edukiaren parte bat zen. Gatz mineralek ere badute zerikusirik koloideekin, proteinak dauzkatenek bereziki; era horretan, gatz jakin batzuek solbagarri bihur ditzakete proteina batzuk, eta beste gatz batzuek berriz hauspearazi egiten dituzte.
Hortaz, proteinen gatz bidezko solbagarri bihurtzean, eragingarriagoak izaten dira gatz batzuk besteak baino. Zehatzago, kontzentrazioaren araberakoa izaten da eraginkortasuna, eta orobat gatzetik abiaturik sorturiko katioiek eta anioiek dauzkaten karga elektrikoen kopuruaren araberakoa. Horregatik, eragingarriagoak dira  eta
eta 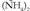
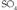 erako gaiak,
erako gaiak, edo
edo 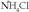 erakoak baino, ioi kopuru handiagoa ematen baitute, eta baita karga dentsitate handiagoa ere ioi bakoitzeko.
erakoak baino, ioi kopuru handiagoa ematen baitute, eta baita karga dentsitate handiagoa ere ioi bakoitzeko.
Gatz bidezko solbagarri bihurtzearen zergatiaren funtsa da ioiek erraztu egiten dutela proteinetan dauden atomo polar taldeeen ioitzea.
Gatz bidezko solbagarri ez bihurtzea gertatzen da proteina bat, kontzentrazio jakin bateko gatz disoluzio batean egonik, hauspeatzen denean. Hauspeatzean parte hartzen duten faktoreetako bat da gatzetik sorturiko ioiak urezko molekula bipolar askok inguratzen dituztela, eta horrekin proteinaren molekulek inguratzen zituen eta barreiaturik mantentzen zituen uraren parte handi bat galtzen dute; orduan hauspeatzen da (8. irudia).




