Izadi Jakintza»Izadi jakintza
Ura

LABURPENA: Ura oso ugari dago lur azalean, eta antzeko beste gaien oso ezaugarri
fisiko-kimiko desberdinak ditu. Berezitasun hori dela-eta, guztiz egokia gertatu da
izaki bizietan eginkizun asko eta asko betetzeko.Ura ohiko gaia da Lurrean; izan ere, planeta
honen hiru laurden daude urez
estaliak. Hain da ugari, non, Lurra, lau-laua
balitz, 2,5 kilometroko sakoneran egongo
bailitzateke murgilduta.
Hainbeste ur dagoela-eta planetan, greziar
jakintsuek beren ustez lau elementu garbiak
ziren haiexen artean ipini zuten: lurra, ura,
airea eta sua, alegia, nahastean, objektu guztiak
sortzen zituzten elementuak. Garbitasunaren
ideiak bere horretan jarraitu zuen,
harik eta 1781ean Henry Cavendish ura oxigeno
eta hidrogenozko konbinazio batez osatua
zegoelako ideiara iritsi zen arte. Joseph
Gay-Lussac-ek frogatu zuen esperimentu
bidez Cavendishen proposamena, bi gasetatik
abiatuta ura sintetizatzea lortu zuenean.
Nolanahi ere, ura gai garbia delako ideiak
bizirik dirau oraindik. Hori dela-eta, hainbat
magnitude neurtzeko erreferentzia gisa
erabili izan da, hala dentsitatea, likatasuna,
bero espezifikoa eta pH-a (ikus aurrerago).
Lur planetan gertatzen den bezalaxe, izaki
biziek ere ur kopuru handiak dauzkate,
%50-90 bitarte. Motaren araberakoa izaten
da (1. irudia) organismoek beren baitan daukaten
kopurua. Mota berean ere ez da beti
berbera izaten uraren portzentaia, adinaren
araberakoa izaten baita, eta, hori dela-eta,
zaharrak baino ur gehiago izaten du izaki
gazteak (I. taula). Errazago ikusten da hori
haragian: zekor xerra samurragoa da behi
xerra baino, ur gehiago baitauka; hala, zekor
zerra bat erretzean urritu egiten da (olioaren
tenperaturak ura lurrinarazten du), behiarenak
baino askoz ere ke gehiago ateratzen du,
eta txinparta gehiago ateratzen. Organismo beraren baitan ere, aldaketak
izaten dira ur edukian. Biologiari dagokionez
aktiboagoak diren ehun eta organoek,
motelagoak direnak baino ur gehiago dute
(II. taula). Zelula metabolismoaren erreakzioak
gerta daitezen behar den ur ingurunean
bilatu behar da horren zergatia. Ehun
aktiboagoetan erreakzio gehiago izango da,
eta lasterragoak izango dira gainera, eta, hori
dela-eta, prozesu horiek gertatzen diren
inguruneak egokitu beharra izango du, eta
isurkari kopurua handitu.
Organismo beraren baitan ere, aldaketak
izaten dira ur edukian. Biologiari dagokionez
aktiboagoak diren ehun eta organoek,
motelagoak direnak baino ur gehiago dute
(II. taula). Zelula metabolismoaren erreakzioak
gerta daitezen behar den ur ingurunean
bilatu behar da horren zergatia. Ehun
aktiboagoetan erreakzio gehiago izango da,
eta lasterragoak izango dira gainera, eta, hori
dela-eta, prozesu horiek gertatzen diren
inguruneak egokitu beharra izango du, eta
isurkari kopurua handitu.
Izaki bizi bat arretaz aztertzen badugu,
izaki horren itxurak gezurtatu egingo digu
aurreko pasarteetan adierazitakoa, izan ere,
barne ingurunea osatzen duten isurkarietan
izan ezik (odola, linfa, izerdia, begi globoak,
giltzadurak, etab.), ez da urik inon antzematen.Organismoetan, hiru gune desberdinetan
izaten da ura:
- Ur ibiltaria. Hauxe da agerikoena, organismo
batzuek gaien garraiorako erabiltzen
duten hodien sisteman zehar mugitzen
dena. Ur guztiaren %8 izaten da gizakiengan.
- Ur betegarria. Zelulen artean dago, zenbaitetan
libre, eta zelula arteko gaiaren parte
dela beste batzuetan (hanpadurazko ura) Ur
hau ez da ikusgaia, baina badu harremanik
ehunen zenbait ezaugarrirekin. Hala, ur
proportzio handia duelako da malgua kartilagoetako
zelula arteko gaia; ur hori adinarekin
galdu egiten da, eta ehun batzuk endekatu
egiten dira, larruazala (malgutasuna
galtzen du, eta zimurtu egiten da), eta kornea
adibidez (zurixka izaten dute zaharrek).
Gizakiengan ur guztiaren %15 izaten da. - Zelula arteko ura. Hau ere ez da ikusten;
zitoplasman eta hainbat zelula organuluren
barruan dago. Gauza bitxia dirudien arren,
ur honen molekulak izotzetan dauden
modu berean daude kokatuak (ikus aurrerago),
ur isurkarian daudenen moduan baino
areago (5. irudia), eta horrek errazago
bihurtzen du zelularen eta organuluen fortik,maren mantentzea. Ur mota hau da ugariena:
organismoan dagoenaren %40 ere izatera
iristen da.
- Zelula arteko ura. Hau ere ez da ikusten;
zitoplasman eta hainbat zelula organuluren
barruan dago. Gauza bitxia dirudien arren,
ur honen molekulak izotzetan dauden
modu berean daude kokatuak (ikus aurrerago),
ur isurkarian daudenen moduan baino
areago (5. irudia), eta horrek errazago
bihurtzen du zelularen eta organuluen fortik,maren mantentzea. Ur mota hau da ugariena:
organismoan dagoenaren %40 ere izatera
iristen da.
Ura, gai berezia
Ura oso gai "arrunta" da planetan, baina horrek ez du esan nahi berezia ez denik. Uraren jokabidea ez da bere mota bereko molekula txikiek izaten dutenetik espero zitekeena; izan ere, guztiz "berezitzat" har daitezke uraren fusio eta lurrintze puntuak (III. taula).
Zergatik da hain berezia ura? Galdera horri erantzuteko, molekularen kimika konposiziora dago itzuli beharra . Oxigenoa oso atomo elektronegatiboa da (elektroiak erakartzen ditu), baina hidrogenoa ez; hori dela-eta, lotura kobalenteak sortzen dira hidrogenoaren eta oxigenoaren artean.
. Oxigenoa oso atomo elektronegatiboa da (elektroiak erakartzen ditu), baina hidrogenoa ez; hori dela-eta, lotura kobalenteak sortzen dira hidrogenoaren eta oxigenoaren artean.
Elektroiek oxigeno egarri handiagoa dutenez gero, gertuago geratzen dira hartatik, eta karga birtual negatiboa hartzen dute. Aitzihidrogeno atomoek, urrunago baitaude
elektroietatik, karga birtual positiboa hartzen
dute.
Honaino ez dago ezer berezirik; hidrogenozko
bi atomoak oxigenoaren alde banatan
jartzen dira, eta orekatu egiten dira molekularen
kargak. Baina, izan, gauzak ez dira
horren errazak; hidrogenoen lotura kobalenteak
105 °C-ko angelu bat eratzen dute
oxigenoarekin, eta, hortaz, aldeetako batean
jartzen da karga positiboa (2. irudia).Horrek bipolar izatearen tasuna eransten dio
ur molekulari. Nahiz eta guztiak batera harturik
karga elektrikorik izan ez, molekularen
alde batek karga positiboak kontzentratzen
ditu, eta negatiboak besteak, dipolo elektrikoa
balitz bezala.
Molekularen bipolaritatea dela-eta, oso
solbatzaile egokia da ioi lotura duten gai
guztientzat, bere ioi hidratatuetan banatzen
baititu horiek. Era berean, gai da lotura
kobalenteak dituzten gaiak, baina talde
polarrak dituztenak, solbatzeko (ioi daitezkeenak,
3. irudikoak bezala).
Kargen desoreka dela-eta, ur molekulek
lotura ahulak era ditzakete oso erraz, hidrogeno
zubi modukoak, beste molekulekin.Molekula arteko loturak eratzeko erraztasunak
beste bi tasun ere ematen dizkio: kohesioa
eta atxikidura. Kohesioa ur molekula
batek aldamenekoekin hidrogeno zubiak
osatzeko duen gaitasuna da; gehienera ere
lau loturakoa izan daiteke (4. irudia).
Ur molekulak elkarrekin loturik egoteak
zurrundu egiten du multzoa; aise ulertzen
da hori izotzaz ari garenean, baina urari
dagokionez harrigarria gertatzen da, ura
normalean isurkaria izaten baita. Horren
zergatia hidrogeno zubien iraupen guztizlaburrean datza; izan ere, loturak etengabe
sortzen eta suntsitzen dira. Horrez gainera,
loturen zenbatekoa tenperaturaren araberakoa
izaten da; badirudi ur isurkarian –une
bakoitzean– molekula bat beste 3,6rekin
dagoela lotua, eta izotzetan berriz, batez
beste, 4 loturaraino izaten dira.
Horren guztiaren ondorioz, ura ez dute
molekula barreiatuek osatzen, aitzitik,
molekula taldeak osatzen dute (gaur egun, 8
banakoko taldeak ere izan daitezkeela onartzen
da), nahiz eta horien artean molekula
bakartuak ere badiren (5. irudia). Atxikiduraren tasuna, ur molekulek
duten gaitasun berezi batetik dator, alegia,
molekula kargadunak, edo bere atomo talderen
bat ioitzean karga daitezkeen molekulak
dauzkan edozein gainalderekin lotzeko
duten gaitasunetik hain zuzen (6. irudia).
Atxikiduraren tasuna, ur molekulek
duten gaitasun berezi batetik dator, alegia,
molekula kargadunak, edo bere atomo talderen
bat ioitzean karga daitezkeen molekulak
dauzkan edozein gainalderekin lotzeko
duten gaitasunetik hain zuzen (6. irudia).
Eguneroko bizitzan, gauzakiak “bustitzeko”
urak duen ahalmenean gauzatzen da
hori guztia. Tasun hori oso garrantzitsua da,
are gehiago, pentsatzen baldin bada su batzuk
itzal ditzakeela urak sutan dagoen gauzakiaren
gainaldeari lotzen zaionean, eta
oxigenorik iristea eragozten duenean; “ito”
egiten du alegia. Jakina denez, beste su batzuk,
molekula kargatuak ez dauzkaten gaietan
sortuak, ezin dira urez itzali. Halaxe gertatzen
da tartean gasolinak eta solbatzaileak
dauden sute kimikoetan.
“Kapilaritatea” da atxikiduraren beste
ondorio bat (7. irudia), eta ezaugarri horri
esker gai desberdinen zirrikituetan sar daiteke
ura (hanpadura). Kapilaritateak oso indar
ahaltsuak eragiten ditu, tartean ur geruza
mehe bat duten beirazko bi xafla banatu nahi
direnean ikus daitekeen bezala; saio bat egindaiteke uraren ordez alkohol geruza bat ipiniz,
eta emaitzak alderatu gero. Kapilaritatearen
indarra ikusten da halaber barruan ura
daukaten beirazko ontzien ertzean; isurkaria
pixka bat igotzen da ertzaren aldetik, “menisko”
deritzana osatuz; horren zergatia da ur
molekulek, hitzez hitz, “igo” egiten direla,
grabitatearen kontra, atxikidurari esker.
Indar hauek oso garrantzitsuak dira izaki
bizi askorentzat; landareetan, adibidez,
indar horri esker igotzen da ura zainetatik
hostoetaraino, hodi zurkaretatik. Giza zibilizazioei
ere erabilgarria gertatu zaie hanpaduraren
gertaera. Adibidez, piramideak eraikitzeko
harriak ateratzen ziren harrobietan,
zurezko ziriak iltzatzen zituzten arrokaren
pitzaduretan; bustitzen zituzten gero, eta,
uretan sartzean handitu egiten baitzen ziria,
askatu egiten zen harri puska.
Ur molekulek beren artean loturik egoteko
duten gaitasunaren ondorioz, oso tasun
bereziak ditu urak:
- Isurkari ia ulertezina da. Itsasoko urak
1.000 m-ko sakoneran duen presiopean
(100 atmosfera), %0,458 besterik ez damurrizten bolumena. Tasun hori guztiz
egokia da zelulen formak bere horretan
iraun dezan, indar handien pean –gehiegizko
presiopean– gertatzen baitira askotan
zelulak.
- Azaleko tentsioa oso handia du. Hau da,
molekulen arteko kohesioa oso handia da
isurkariaren azalean, eta, hori dela-eta, geruza
mehe-mehea osatzen dute. Hobeto ulertuko
da hori beira lehor baten gainean ur
tanta batzuk botaz; ikusiko da atxikita geratzen
direla, eta forma erdi esferikoa hartzen
dutela; azaleko molekulak loturik dauden
indarrari zor zaio hori, indar horrek baitauzka
“bere baitan” barneko molekulak; saio
bera alkohola erabiliz egiten badugu, ikusiko
dugu alkohola zabaldu egiten dela, batere
tantarik eratu gabe.
Azaleko tentsio handi hori dela-eta, intsektu
asko irristatu egiten da ur azalean; eta,
hori baino garrantzitsuagoa, lanean laguntzen
dio zelula mintz meheari, zelularen
edukiari eutsiz.
- Bero espezifikoa oso garaia du, hau da,
energia asko behar da uraren tenperatura
igoarazteko eta, alderantziz, oso motel galtzen
du energia.
Horrelako kasuetan, hain zuzen, balio du
urak –erreferentzia gisa– magnitude baten
neurri banakoa definitzeko, kaloriarena
hain zuzen ere. Ur garbizko gramo baten (1
cm 3 ) tenperatura 1 °C igotzeko behar den
energia kopurua da kaloria.
Eguneroko bizimoduan, sukaldean ikusten
da oso erraz tasun hori. Olioa surtan
jarri zartagi batean, eta eltzeko ura baino
askoz ere lehenago berotzen da; bestalde,
denok dakigu zopa baino lehenago hozten
direla jaki frijituak.
Bero espezifikoa zer den jakiteko, molekula
mailara jo beharra dago, eta ikusi ea zer
gertatzen den inguruneari ura eransten zaionean;
horren ondorioz, molekulak lasterrago
dardaratzen dira, eta gora egiten du gauzakiaren
tenperaturak. Gogoratu beharra dago
atomoak eta molekulak, guztiz egonkor izateko,
0 °C Kelvin-etan behar dutela egon
(zero absolutu ere esaten zaio gradu horri).
Urari energia eransten zaionean, molekulek
ezin dute beren dardara areagotu, hidrogenozko
zubien bidez baitaude lotuak, eta, hori
dela-eta, loturak hausten kontsumitu beharra
du hartutako energiaren parte handi batek.
Horregatik, isurkariaren tenperaturak ez du
gora egiten ia, nahiz eta energia asko beretu.
- Lurrintze bero handia du, hau da, energia
asko behar du isurkaritik gas egoerara igarotzeko.
Molekulak elkarrekin lotzen dituzten
hidrogeno zubiak hautsi beharra da
horren zergatia. Lehen esan den bezala, ur
isurkariak 3,6 lotura ditu, batez beste, une
bakoitzean, eta ezin du gas egoerara igaro
lotura horiek denak desagertu arte.
- Dentsitate handiagoa du isurkari denean
egoera gotorrean baino. Izotza ur azalean geratzea, hondoratu gabe, gauza guztiz normala
iruditzen zaigu. Izan ere, ur isurkariak
baino bolumen handiagoa du izotzak, %9
bat. Beste gai batzuetan ez da horrelakorik
gertatzen, askoz ere bilduagoak baitaude
molekulak (lotura bidez) gotorrak direnean
isurkari direnean baino, eta, hori dela-eta,
handiagoa da dentsitatea ur isurkaritan.
geratzea, hondoratu gabe, gauza guztiz normala
iruditzen zaigu. Izan ere, ur isurkariak
baino bolumen handiagoa du izotzak, %9
bat. Beste gai batzuetan ez da horrelakorik
gertatzen, askoz ere bilduagoak baitaude
molekulak (lotura bidez) gotorrak direnean
isurkari direnean baino, eta, hori dela-eta,
handiagoa da dentsitatea ur isurkaritan.
Urak, izozten denean, beste edozein gairen
jokabide bera du; uraren molekulak
elkartu egiten dira hidrogenozko zubi gehiagoren
bidez. Nolanahi ere, modu finkoz
ordenatzen dira loturak espazioan. Horrez
gainera, hidrogeno zubien eratzea eta desegitea
geldiroago gertatzen da izotzetan ur
isurkarian baino. Hala, hexagono baten
erpinak hartuz kokatzen dira gutxi gorabehera
molekulak; horrela ordenaturik daudenean,
molekula gutxiago dago bolumen
jakin batean ur isurkaritan baino.
Tasun horri esker, itsasoen eta ibaien hondoak
ez dira izozten nahiz eta ur azalean
izotz geruza bat osatu, geruza horrek bakartzaile
gisa jokatzen baitu, eta ez du uzten
azpian duen urak beroa gal dezan.
Bada azken tasun bat molekularen izaera
bipolarraren mendeko ez dena: uraren ioitze
maila apala. Hau ulertzeko, kontuan izan
behar da ura disoziatzeko gai dela, hurrengo
formularen arabera: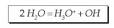 Gertatu, gertatzen da ur molekula bat gai dela beste molekula bati hidrogeno nukleo bat “lapurtzeko”, baina ez elektroia, elektroia “emailearen” oxigenotik oso hurbila baita. Horren ondorioz, molekula bat hidronio bihurtzen da
Gertatu, gertatzen da ur molekula bat gai dela beste molekula bati hidrogeno nukleo bat “lapurtzeko”, baina ez elektroia, elektroia “emailearen” oxigenotik oso hurbila baita. Horren ondorioz, molekula bat hidronio bihurtzen da , eta hidroxilo bestea
, eta hidroxilo bestea . Kendutako protoia oso mugikorra da, eta molekula batetik bestera egiten dute jauzi (horrek esplikatzen du ura korronte elektrikoaren eroale izatea). Hori dela-eta, era honetan sinplifika daiteke erreakzioa:
. Kendutako protoia oso mugikorra da, eta molekula batetik bestera egiten dute jauzi (horrek esplikatzen du ura korronte elektrikoaren eroale izatea). Hori dela-eta, era honetan sinplifika daiteke erreakzioa: Formula hori, berez, konplexuagoa da, uretan ez baita inoiz protoi librerik izaten; areago, ioi hidroniorik ere ez dago, hidratatu egiten baita
Formula hori, berez, konplexuagoa da, uretan ez baita inoiz protoi librerik izaten; areago, ioi hidroniorik ere ez dago, hidratatu egiten baita  osatzeko. Izan ere, 9 4 protoiaren mugikortasuna dela-eta, hidronio bakoitzak eta hidroxilo jakin batzuek bizitza guztiz laburra dute;
osatzeko. Izan ere, 9 4 protoiaren mugikortasuna dela-eta, hidronio bakoitzak eta hidroxilo jakin batzuek bizitza guztiz laburra dute; 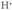 jauzika joaten da molekula batetik bestera, benetan protoi librea balitz bezala.
jauzika joaten da molekula batetik bestera, benetan protoi librea balitz bezala.
Disoziazioa oso molekula gutxiri gertatzen zaie, zehazki, 555.000.000-etatik bati; edo, beste era batera esanda, litroko  molekulari besterik ez.
molekulari besterik ez.
Oreka kimikoa gidatzen duten legeen arabera, litroko  mol izango dira sortzen den ioi bakoitzeko.Tasun hori erabili izan da ingurunearen
erreaktibitatea kalkulatzeko, hau da, pH-a.
mol izango dira sortzen den ioi bakoitzeko.Tasun hori erabili izan da ingurunearen
erreaktibitatea kalkulatzeko, hau da, pH-a.
Halako kalkuluetan, erreferentzia gisa erabiltzen
da ur garbia, eta balio neutroa egozten
zaio.
Ura izaki bizietan
Organismoetan urak duen portzentaia aztertzen denean, guztiz agerikoa gertatzen da urak izaki bizietan duen garrantzia. Gizakietan, adibidez, gorputzeko uraren %20 galtzeak galera konponezinak eragiten dizkio organismoari, ez baita gernurik sortzen, eta hondakinak ez dira kanporatzen.Zergatik da ura hain garrantzitsua izaki
bizietan? Pentsatu beharra dago urak
garrantzi handiko eginkizunak betetzen
dituela organismoen baitan. Horien artean
azpimarratu behar dira:
- Gaien solbatzaile izatea. Betekizun hau
polo biko molekula izatetik datorkio, horri
esker era askotako gaiak solba baititzake. Gaitasun
honek errazago egiten du atomoen eta
molekulen mugikortasuna, eta, hortaz, baita
metabolismoaren erreakzioak ere, erreakzio
horiek uretan gertatzen baitira normalean.
- Eginkizun biokimikoa. Urak berezkoa
duen ioitze gaitasunari zor zaio, horri esker
molekula batean sar baitaiteke, eta hidratatu
eta hautsi egiten du (hidrolisia), 8. irudiko
erreakzioetan ageri den bezala.
- Garraio eginkizuna. Zelulen eta organismo
batzuen (anelidoen) formari eusten
laguntzen du. Eginkizun hori betetzeko,
bere konprimagarritasun falta ia osoaz
baliatzen da, eta azaleko tentsio garaiaz.
- Eginkizun mekaniko biguntzailea. Urak
organoek elkarrekin igurtzitzea eragozten
du; guztiz ageriko da hori giltzaduretakosinobia zorroetan, hezurren arteko igurtzitzea
eragozten duten bigungarri gisa jokatzen
baitute. Organo asko (birikak, bihotza),
isurkaria barruan presio handian duten
poltsetan sartuak daude, eta, horri esker,
gorputzeko edo beste organoetako paretek
ez dituzte jotzen, eta ez dira kaltetuak gertatzen.
Uraren betekizun hau isurkari konprimagarri
izateari zor zaio.
- Funtzio termoerregulatzailea. Izerditzen
garenean, ura kanporatzen dugu poroetatik;
ur hori, larruazaleko beroa hartuta, lurrindu
egiten da, eta hoztu egiten da larruazala.
Ekosistemari dagokionez, planetako leku
askotako eremu zabalen klima erregulatzen
dute ur masa handiek; ikusi besterik ez dago
nolako aldeak izaten den kostaldeko tenperaturen
eta barnealdekoen artean. Uraren
bero espezifiko garaia eta lurrintze handia
baliatzen dira eginkizun horretan.
Izaki bizien sorreran eta bilakaeran izan
duen garrantzia da uraren garrantzia neurtzeko
azken alderdia. Uretan sortu zen bizitza,
eta, luzaroan (kanbrikoraino), planetaren
itsaso primitiboetan bakarrik bilakatu
ziren organismoak. Lurra kolonizatu zuten
izaki biziek ezin izan zuten beren sorgunea
ukatu, eta, hala, nahitaezko dute isurkari
hau, eta oso ugari dute beren barnean.
Bukatzeko, eta bizitzaren jatorria dela-eta,
zientzialari batzuek hainbat teoria proposatu
dute, bizitza bestelako baldintzetan asmatu
nahian nolakoa izan ote zitekeen. Proposamen
horien arabera, tenperatura
apalagoko eta presio garaiagoko giroetan,
beste isurkari batzuek beteko lukete uraren
papera. Isurkari horien artean, amoniakoak
dirudi hoberena (9. irudia), bestelako gaien
“itsasoak” ere aurkitu diren arren Eguzki sistemako
satelite batzuetan, metanozkoak
adibidez.






