Fisika-Kimika»Fisika - Kimika
Karbonoaren kimika
Sarrera
Izenburu horren barruan orobat sartzen da —eta ezagunagoa da agian izen honekin— kimika organikoa delakoa. Zertaz arduratzen da kimika organikoa? Karbono eta hidrogeno loturak dituzten konposatuez batez ere. Hasieran izen hori ipini bazitzaion, talde horretan sartzen ziren konposatuak landare eta animalien mundukoak zirelako ipini zitzaion hala. Baina 1928an Friedrich Wöhlerrek, amonio zianatotik abiatuz, urea sintetizatu zuenean, alde batera utzi zen “bizitzaren berezko indarraren teoria”, aho batez onartua ordu arte. Teoria horren arabera, izaki bizidunetan agertzen ziren konposatuak izaki bizidunek bakarrik sintetiza zitzaketen. Egun, gauza arrunta da sustantzia ez-organikoetatik abiatuz organikoak lortzea.
Karbonoa IV-A taldeko lehen elementua da eta 4 elektroi ditu bere kanpoko geruzan: beraz, beste 4 elementurekin edo karbonoarekin berarekin eratu daiteke. Karbonoak —Lurraren gainazalean oso gutxi dago (%0,027)— garrantzi handiko propietate berezi bat du, alegia, karbonoarekin berarekin konbinatuz miloika konposatu sor ditzakeela. Izan ere, karbono atomoak elkarrekin lotzen baitira kateak, katea adarkatuak eta eraztunak sortuz.
Konposatu organikoen iturburu nagusia petrolioa, gas naturala eta ikatza dira. Petrolioa eta gas naturala hidrokarburo aseez —atomoen artean soilik lotura sinpleak dituztenak dira hidrokarburo aseak— osaturik daude gehienbat. Lehengai horiek erregai gisa erabiltzen diren aldetik ezagutzen dira batez ere, baina ez da ahaztu behar material organiko sintetiko gehienak horiexetatik lortzen direla. Erabili ere, gauza askotarako erabiltzen dira konposatu organikoak, hala nola, ehunak, erregaiak, plastikoak, pinturak, sendagaiak, ontziak eta abar egiteko.
Funtzio taldeak
Milioka konposatu organiko ezagutzen da. Nola egin haien azterketa sailkapen egoki bat egin gabe aurretik? Eta nola egin daiteke sailkapen hori?
Konposatu organikoetan karbonoak lotura kobalenteak egiten ditu. Lotura horien polaritatea lotutako atomoaren elektronegatibotasunaren araberakoa izaten da. Konposatu organiko sinpleenak hidrokarburoak dira; karbono eta hidrogeno hutsez osaturik daude. Funtsean, karbono atomoek elkarrekin lotzean osatzen dituzten kateak baizik ez dira hidrokarburo molekulak. Katea horiek linealak, adarkatuak edo itxiak izan daitezke (ziklikoak). Katea nagusiko kar - bono atomo horiei hidrogeno atomoak lotuko zaizkie lotura kobalentez. Karbono atomoen arteko loturak bakunak direnean hidrokarburoaseak deritze, eta erreaktibotasun ahalmen txikia dute, C-C eta C-H loturak sendoak izanik molekulak ez baitira oso polarrak. Ematen dituzten erreakzioen artean ordezkatze erreakzioak eta —oxigenoarekin nahasturik— errekuntza dira, nagusietako bi. Ordezkatze erreakzioetan hidrokarburoaren hidrogeno atomo bat (edo bat baino gehiago) beste atomo batzuez (halogenoak, gehienetan) ordezkatzen dira. Errekuntza erreakzioa dela-eta erabiltzen dira hidrokarburoak erregai gisa.

Lotura bikoitz edo hirukoitzen bat agertzen denean karbono atomoen artean hidrokarburo asegabeez hitz egiten da. Hidrokarburo asegabeek erreaktibotasun handiagoa dute. Erreakzio mota ezagunena adizio edo gehikuntzarena da, non atomo berriak lotura anizkoitzari gehitzen baitzaizkio lotura bakunak eratuz.

Hidrokarburo asegabeen artean hidrokarburo aromatikoek oso talde bitxia osatzen dute. Bentzenoaren egitura zikliko asegabea agertzen da guztietan.
Nola izenda daitezke hidrokarburoak?
Hidrokarburo aseen kasuan (atomoen artean C-C lotura bakunak soilik dituztenen kasuan),
hau da haien formula enpiriko orokorra:  ,
(n-k karbono atomoen kopurua adierazten du). Hidrokarburo horiek izendatzean, aurrizki bat jartzen da atomo
kopurua zehazteko, eta bukaeran -ANO atzizkia eransten da, hidrokarburo asea dela adierazteko.
,
(n-k karbono atomoen kopurua adierazten du). Hidrokarburo horiek izendatzean, aurrizki bat jartzen da atomo
kopurua zehazteko, eta bukaeran -ANO atzizkia eransten da, hidrokarburo asea dela adierazteko.

Adibidez:

Hidrokarburo ase horietatik adarrak irteten direnean, -il atzizkia erabiltzen da hidrokarburo adarra dela adierazteko:
Adibidez:

Hidrokarburo batzuek, bestalde, lerroan eratu ordez, ziklo bat osatzen dute. Halakoen aurretik ziklo- erabiltzen da:
Adibidez:
ziklopentanoa 
Hidrokarburo asegabeetan lotura bikoitzak edo hirukoitzak gerta daitezke. Bakarrik lotura bikoitzak agertzen direnean -eno atzizkikia erabiltzen da -ano atzizkiaren ordez, eta zenbaki baten bidez adierazten da lotura non dagoen.
Adibidez:

Lotura hirukoitzetarako -ino erabiltzen da:


Gainerako konposatu organikoetan katea hidrokarbonodun bat izango dugu, eta atomo multzo
bereizgarriren bat hari lotua. Atomo multzo horrek emango dizkio gehienetan propietate bereziak
sustantzia horri. Atomo multzo horrek emango dio sustantziari erreaktibotasun bereizgarria, eta horrexegatik
funtzio talde izena ematen zaie. Adibidez: 1-butanol (n-butanol),

 formula duena,
bi zatitan bereiz daiteke: alegia, batetik, butilo taldea
formula duena,
bi zatitan bereiz daiteke: alegia, batetik, butilo taldea  ,
eta, bestetik, hidroxilo taldea (-OH).
Azken hori da funtzio taldea, erreakzio arruntetan erreakzionatu
eta talde berriak ematen dituena. -OH taldearen portaera kimikoa
ezagutuz gero, hidroxilo taldea duten sustantziek zer nolako
erreakzioak ematen dituzten jakin daiteke. Talde hori duten sustantziak
alkohol izenaz ezagutzen dira eta R-OH ikurraz adierazten
dira (R, oro har, katea hidrokarbonoduna da). Sailkatze horri esker
milioka konposaturen propietateak talde gutxi batzuetan bil daitezke.
,
eta, bestetik, hidroxilo taldea (-OH).
Azken hori da funtzio taldea, erreakzio arruntetan erreakzionatu
eta talde berriak ematen dituena. -OH taldearen portaera kimikoa
ezagutuz gero, hidroxilo taldea duten sustantziek zer nolako
erreakzioak ematen dituzten jakin daiteke. Talde hori duten sustantziak
alkohol izenaz ezagutzen dira eta R-OH ikurraz adierazten
dira (R, oro har, katea hidrokarbonoduna da). Sailkatze horri esker
milioka konposaturen propietateak talde gutxi batzuetan bil daitezke.
Sustantzia organikoetan funtzio taldeak aldatu gabe irauten duenean, eta soilik katea hidrokarbonodunaren luzera aldatzen denean, serie homologo bat osatzen dutela esan ohi da
Hidrokarburo aromatikoak
Bentzenoaren familiako konposatuak daude deitura horren azpian. XIX. mendeaz gero,
konposatu aromatiko esan zitzaien usain oneko sustantzia batzuei: bainilla, iltze kanelaren olioa,
kanela, benjui, eta abarri. Geroago jakin zen bentzenotik eratorriak zirela. Bentzenoak, ordea,
ez du batere usain onik. Hidrokarburo asegabea da (hots, lotura bikoitzak ditu bere egituran),
konposatu ziklikoa, eta  du formula. Hasieran, formula horretako 6 atomo karbonoren artean hiru lotura bakun eta hiru bikoitz izango
zirela proposatu zen. 1920-1930 urteetan ezaguna zen bentzenoa molekula laua zela eta bere C-C lotura
guztiak berdinak zirela. Gaur egun proposatzen den egituran, berriz, bentzeno molekulan 6 karbono
atomoak elkarrekin loturik daude, lotura bakunez loturik, eta geratzen diren beste 6 elektroiak
uniformeki eta homogeneoki zabaltzen dira 6 karbono atomo horien artean, hodei elektroniko baten antzera.
du formula. Hasieran, formula horretako 6 atomo karbonoren artean hiru lotura bakun eta hiru bikoitz izango
zirela proposatu zen. 1920-1930 urteetan ezaguna zen bentzenoa molekula laua zela eta bere C-C lotura
guztiak berdinak zirela. Gaur egun proposatzen den egituran, berriz, bentzeno molekulan 6 karbono
atomoak elkarrekin loturik daude, lotura bakunez loturik, eta geratzen diren beste 6 elektroiak
uniformeki eta homogeneoki zabaltzen dira 6 karbono atomo horien artean, hodei elektroniko baten antzera.

Egitura zikliko horri eraztun aromatikoa esan ohi zaio. Eraztun aromatikoa oso egonkorra da, ez du lotura bikoitzen adinako erreaktibotasunik, eta erreakzioan bere hidrogenoak ordezkatzen dira batez ere, lotura bikoitzak galdu gabe.
Hidrokarburo aromatikoen artean sustantzia ezagun asko dago —naftalenoa, antrazenoa, testosterona, trinitrotoluenoa (TNT), eta abar—.

Oxigenoa duten funtzio taldeak
Alkoholak: R-OH ikurraz adierazten dira. R erradikalaren izaeraren arabera alkohol primario, sekundario edo tertziario izan daitezke. Primarioetan, -OH taldeari loturiko karbonoa karbono bakar bati lotua egongo da (gainerako loturak hidrogenoarekin aseko ditu); sekundarioetan, aldiz, bi karbono atomori lotua egongo da (laugarren lotura hidrogenoarekin aseko du); eta tertziarioetan R erradikaleko karbonoa beste hiru karbonori lotuko zaio (hidrogenoarekin loturarik ez). Alkoholak, oro har, ongi disolbatzen dira uretan (R erradikala luzeegia ez denean behintzat). -OH talde bat baino gehiago baldin badaude molekula berean, poliol esaten zaio. Poliolak —azukrea edo glizerina, adibidez— erraz disolbatzen dira uretan eta ez dira oso hegaskorrak. Alkoholak izendatzeko -ol atzizkia eransten zaio hidrokarburoaren erroari —butanola, etanola, propanola…—, edo alkohol hitza jartzen da aurretik eta -iliko atzizkia eransten zaio hidrokarburoaren erroari —alkohol butilikoa, alkohol etilikoa, alkohol propilikoa…—.
Alkoholen artean bada talde berezi bat, fenolak. Fenoletan hidroxilo taldea eraztun aromatiko bati lotua dago, eta, horregatik, -OH taldearen erreaktibotasuna ez da gainerako alkoholena bezalakoa (alkohol arruntak baino azidoagoak dira).
Eterrak: R-O-R’ egitura dute. Alkoholek baino polartasun txikiagoa dutenez hegaskorragoak
dira, eta ez dira hain erraz disolbatzen uretan. Sustantzia horiek izendatzeko eter hitza ipintzen
da R eta R’ erradikalen izenen ondoren: 
Zetonak eta aldehidoak: C=O karbonilo taldea dute. Talde hori katea barruan denean zetona da,
eta katearen bukaeran denean, berriz, aldehidoa. Oxigenoarekin duen lotura bikoitza dela-eta,
eterrak baino polarragoak dira. Zetonak eterren antzera izendatzen dira:
 etil metil zetona (edo butanona).
Aldehidoak, berriz, alkoholen antzera:
etil metil zetona (edo butanona).
Aldehidoak, berriz, alkoholen antzera:  etanala.
Aldehidoek eta zetonek antzeko propietateak dituzte, baina aldehidoek erreaktibotasun handiagoa dute.
etanala.
Aldehidoek eta zetonek antzeko propietateak dituzte, baina aldehidoek erreaktibotasun handiagoa dute.
Azidoak: R-COOH formulaz adierazten dira. Talde hidrokarbonodunari karbonilo bat eta hidroxilo
bat lotzen zaizkio. Sustantzia horien propietate nagusia duten azidotasuna da. R oso handia ez den
bitartean ongi disolbatzen dira uretan eta ez dira hegaskorrak. Azido ez-organikoak baino askoz ahulagoak dira.
Izendatzeko, aurretik azido hitza ipini ondoren, katea hidrokarbonodunaren izenari -oiko atzizkia ipintzen zaio:
 azido propanoikoa.
azido propanoikoa.
Katea luzeko (15-18 karbono atomo) azido organikoak metal alkalinoekin erreakzionaraztean gatz organikoak
sortzen dira. Horrelakoak dira, adibidez, xaboiak. Uretan disolbatzean ionizaturik agertuko dira: batetik,
katioi alkalinoa, eta, bestetik, katea hidrokarbonodunaren anioia. Anioi honetan bi zati bereizten dira:
erradikal karbonoduna (uretan disolbaezina; hots, hidrofoboa) eta
 taldea
(uretan disolbagarria; hots, hidrofiloa). Izaera bikoitz hori dela eta, dute anioiek garbitzeko ahalmena.
taldea
(uretan disolbagarria; hots, hidrofiloa). Izaera bikoitz hori dela eta, dute anioiek garbitzeko ahalmena.

Esterrak: azido organikoen antzekoak dira, baina katea amaierako hidrogenoaren ordez beste erradikal organiko bat dute (R’); hots, R-COOR’. Azido organiko bat alkohol batekin erreakzionaraztean orekan esterra eta ura lortuko dira. Esterra izendatzeko, alkoholaren erradikalaren izenaren atzetik -ato atzizkia ipintzen zaio jatorrizko azido organikoari: azido azetiko + propanol = propil azetato. Erreakzio hori geldo samarra da eta erreakziogaiak luzaroan mantendu behar dira irakiten.
Ester sinpleek oso usain ona dute: lore gehienen usaina haiek eragiten dute; gozogintzan erabiltzen diren fruitu urrin gehienak ere haien bidez lortzen dira. Pisu molekular txikiko esterrek egoki disolbatzen dituzte sustantzia apolarrak. Etil azetatoa, adibidez, oso egokia da azazkalak margotzeko lakak garbitzeko.

Badira beste funtzio talde batzuk oxigenoa dutenak, baina orain arte azaldutako horiek dira ezagunenak
Nitrogenoa duten funtzio taldeak
Aminak: Amoniakoaren familiakoak dira. Amoniakoaren (NH3) hidrogeno bat, bi edo
hiru erradikal organikoez ordezkatzean, amina primario, sekundario edo tertziario bat lortuko da. Aminak basikoak
dira, eta oso usain txarra dute (arrain ustelar en kiratsa, adibidez, amina batek eragiten du).
Aminak izendatzeko, hidrogenoen ordez jarritako erradikalak izendatu ondoren, amina atzizkia erantsi behar da:
 etilmetilamina.
etilmetilamina.
Amina ezagunak: nikotina, anilina, estriknina, eta abar.
Amidak: azido organiko baten eta amina baten konbinazioz sortzen direla esan daiteke.
Formula orokorra RCON-R’R» dute (R, R’ eta R» katea hidrokarbonodunak edo hidrogeno atomoak dira).
Azido azetiko eta anilinatik datorren azetanilida buruko minak eta neuralgiak kentzeko erabili ohi da.
Haien artean oso garrantzitsuak dira amida polimerikoak edo poliamidak. Amidak izanik oso katea
luzeak sortzen dituzte, eta hori dela eta, pr opietate bereziak dituzte. Poliamiden artean ezagunena nylona da.
Zuntzak egiteko erabiltzen da eta garrantzi handikoa da jantzigintzan. Izendatzeko, nitrogenoari lotua doazen
erradikalen izenen atzetik jatorrizko azidoaren izena ipintzen da, eta -amida atzizkia eransten zaio ondoren:
 N,N-dimetil propanamida.
N,N-dimetil propanamida.
Nitrokonposatuak:  itxurako konposatuak dira. R erradikala aromatikoa denean konposatu ezagunenak ditugu —trinitrotoluenoa (TNT)—.
Badira beste batzuk ere ezagunak, hala nola, nitroglizerina, zelulosa nitratoa eta abar. Konposatu horiek izendatzeko
R erradikalaren izenaren aurretik nitro- aurrizkia ipintzen da:
itxurako konposatuak dira. R erradikala aromatikoa denean konposatu ezagunenak ditugu —trinitrotoluenoa (TNT)—.
Badira beste batzuk ere ezagunak, hala nola, nitroglizerina, zelulosa nitratoa eta abar. Konposatu horiek izendatzeko
R erradikalaren izenaren aurretik nitro- aurrizkia ipintzen da: 
 nitrobentzenoa.
nitrobentzenoa.
Nitriloak: azido zianhidrikotik eratorriak direla esan daiteke
(HCN eta hidrogenoaren lekuan R erradikal bat dute). Haiek izendatzekobukaera
ipintzen da erradikalaren izenaren atzetik:
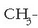
 ,
adibidez, propanonitrilo edo etil zianuroa da.
,
adibidez, propanonitrilo edo etil zianuroa da.
Halogenoak dituzten funtzio taldeak
Konposatu halogenodunak ez dira oso ugariak izadian, baina oso erabiliak dira
beste substantzia batzuk sintetizatzeko, garrantzi handiko zeregina baitute bitarteko gisa.
Hidrokarburo batean hidrogeno atomoren bat halogeno batez ordezkatzean lortzen dira. H
aiek izendatzeko, halogenoaren izena ipini behar da jatorrizko katearen izenaren aurretik,
eta zenbaki baten bidez adierazten da halogenoa non dagoen:
 2-kloropentanoa.
2-kloropentanoa.
Pestizida asko hidrokarburo halogenodunak dira, klorodunak zehatzago esanda. Horien artean ezagunenetako bat DDT-a da. Gaur egun, intsektuak hiltzeko gai klorodun asko debekatuta daude, ingurugiroari, animaliei eta gizakiei egiten dioten kaltea dela eta.
Beste gai ezagun batzuk hidrokarburo klorofluorodunak dira. Gai klorofluorokarbonodunak aerosoletan erabili izan dira urteetan, bultzatzaile gisa, baina, gaur egun, debekatuta daude, ozono geruzari egiten dioten kaltea dela eta.
Isomeria
Formula ez-organiko bat idazten denean —  ,
adibidez- sustantzia jakin bat adierazten da -azido sulfurikoa, hain zuzen, kasu honetan-.
Kimika organikoan, ordea, gisa horretako formula batek -
,
adibidez- sustantzia jakin bat adierazten da -azido sulfurikoa, hain zuzen, kasu honetan-.
Kimika organikoan, ordea, gisa horretako formula batek -  ,
adibidez-, gai desberdinak adieraz ditzake -n-butanoa edo isobutanoa, hain zuzen, kasu honetan-.
,
adibidez-, gai desberdinak adieraz ditzake -n-butanoa edo isobutanoa, hain zuzen, kasu honetan-.
Adibidez,  formula enpirikoa duten egitura desberdinak egon daitezke:
formula enpirikoa duten egitura desberdinak egon daitezke:

Molekularen formula berdina izanik egitura desberdina duten gaiez isomeroak direla esaten da. Isomeria mota bat baino gehiago dago: a) katea isomeria (funtzio taldea berdina baina katearen egitura desberdina dutenak); b) kokagune isomeria (funtzio taldea lekuz aldatzen dutenean katean zehar); c) funtzio isomeria (funtzio taldea desberdina dutenak); d) geometria isomeria edo isomeria geometrikoa (lotura bikoitzeko sustantzien artekoa); e) eta isomeria optikoa (karbono atomo bat lau ordezkatzaile desberdinekin lotuta dagoenean azalduko dena).

Isomeria optikoa garrantzi handiko fenomenoa da izaki bizidunetan gertatzen diren erreakzio biokimiko gehienetan. Karbono atomoaren inguruan lau ordezkatzaile jartzen direnean, egiturak tetraedro baten itxura hartzen du espazioan. Egitura hori bi eratakoa izan daiteke, bata bestearen ispilu. Hala ere, egitura bat ezin da bestearen gainean ezarri, ez baitira berdin-berdinak. Erdiko karbono atomoari karbono asimetrikoa edo kirala esaten zaio, eta ispiluaren bi aldeetan dauden egitura bakoitzari, berriz, enantiomero. Enantiomero bat duen ontzi batean zehar argi polarizatua igaroaraztean argiaren planoa desbideratzeari esaten zaio isomeria optikoa; enantiomeroetako batek ezkerraldera desbideratzen du eta besteak, berriz, eskuinaldera. Gorabehera txiki horrek sekulako eragina izan dezake sustantzia horien portaera kimikoan. Izaki bizidunetan gertatzen diren erreakzio kimiko askotan enantiomero bietatik batek bakarrik erreakzionatzen du. Erreakzio horietan agertzen diren katalizatzaile biologikoak —entzimak— oso selektiboak izaten dira eta enantiomeroetako bat onartzen dute bakarrik. Bestalde, propietate fisikoak ere desberdinak izan daitezke. Limonenoak, adibidez, isomeria optikoa du; enantiomeroetako batek limoi usaina du eta besteak, aldiz, laranja usaina.
Petrolioa
Hidrokarburoz osaturiko nahaste bat da petrolioa. Horrek ez du esan nahi, ordea, petrolio mota guztietako hidrokarburo nahasteak osagai berdin-berdinak dituenik. Petrolioa destilatzerakoan gai desberdinak bereizten dira (ikus taula).


Hain handia izanik gasolina eskaera, hidrokarburo handi edo luzeenak puskatu egin behar izaten dira petrolio upela batetik ahalik eta gasolina gehien lortzeko. Puskatze prozesu horri craking esan ohi zaio. Pisu molekular handiko hidrokarburo aseak oxigenorik gabe berotzean —eta katalizatzaile egokiak izanez gero— apurtu egiten dira, eta katea motzeko hidrokarburoak sortzen dira. Hidrokarburo horiek dira, hain zuzen, gasolinan erabiltzen direnak.
Motorrerako ona izan dadin, gasolinak propietate hauek izan behar ditu: a) Hidrokarburo hegaskorren kantitate egokia izan behar du, motorra erraz piz dadin; b) Ez du hondakin gomazkorik izan behar, balbulen higitzea eragotz baitezake; c) Litro bakoitzeko kilometro kopuru minimo bat ziurtatu behar du; d) Ez du eztandarik eragin behar. Izan ere, aire-erregai nahasketa zilindroetan azkarregi pizten baldin bada, motorrak eztanda egingo du, pistoiari kolpe handia eragingo dio, eta autoa kolpeka bezala ibiliko da. Hidrokarburo linealek errazago eragiten dute eztanda hidrokarburo adarkatuek baino. Gasolinak eztanda ez eragiteko duen ahalmena oktanotan neurtzen da. Gasolinaren oktano kopuruak, beraz, barne errekuntzako motorren aire-erregai nahasketak motorrean eztandarik eragin gabe jasan dezakeen gehienezko konpresioa adierazten du. Iso-oktanoak (2,2,4-trimetil-pentanoa) errekuntzarako propietate ezin hobeak ditu, eta, hitzarmenez, oktano kopurua 100 duela esaten da. Aldiz, n-heptanoa oso gaizki erretzen da, eta oktano kopurua 0 duela esaten da. Oktanoen eskala osatzeko, beraz, isooktano eta n-heptano nahasteek motorrean erretzean eragiten duten eztanda kopurua neurtzen da. Hala beraz, 90 oktanoko gasolina %90 iso-oktanoz eta %10 n-heptanoz osaturiko nahasteak eragingo lukeen eztanda kopuru bera emango duena izango da. Badira, nolanahi ere, 100 oktano baino gehiagoko gasolinak, hegazkinetan-eta erabiltzen direnak, adibidez.
Urte askotan tetraetilberuna erabili da  gasolinetan errekuntza
hobetu eta oktano kopurua handitzeko. Azken urte hauetan,
baina, eguratsera askatzen den berunak ingurugiroan duen
eragin kaltegarriaz oharturik, «berunik gabeko gasolina» saltzen da
gasolinetan errekuntza
hobetu eta oktano kopurua handitzeko. Azken urte hauetan,
baina, eguratsera askatzen den berunak ingurugiroan duen
eragin kaltegarriaz oharturik, «berunik gabeko gasolina» saltzen da
Molekula erraldoiak: makromolekulak
Sustantzia guztiak atomoz osaturik daude eta gehienetan atomo horiek elkarrekin lotuta daude.
Oxigenoa, adibidez, molekula diatomikoa da baldintza normaletan. Sodio kloruroan, esate baterako,
atomoak elkarrekin loturik daude, hiru dimentsioko sare moduko bat eratuz. Diamantea —eta orobat silizea ere—
lotura kobalentez loturik dauden karbono atomoen sare bat da. Silizearen kasuan
 , berriz,
silizio eta oxigeno atomoak 1:2 proportzioan daude, hiru dimentsioko sare bat eratuz. Bai diamantea
bai silizea molekula erraldoitzat har daitezke. Atal honetan molekula erraldoi or - ganikoez arduratuko gara,
makromolekulez alegia. Pisu molekularraren muga non jarri erabakitzea ez da gauza erraza.
, berriz,
silizio eta oxigeno atomoak 1:2 proportzioan daude, hiru dimentsioko sare bat eratuz. Bai diamantea
bai silizea molekula erraldoitzat har daitezke. Atal honetan molekula erraldoi or - ganikoez arduratuko gara,
makromolekulez alegia. Pisu molekularraren muga non jarri erabakitzea ez da gauza erraza.

Polimero ezberdinak gure egunoroko bizitzan erabiltzen ditugu: Poli(etilen tereftalato)a (PET), Poliestirenoa (PS), Polietilenoa (PE) edo Poli (metil metakrilatoa) (PMMA) adibidez.
Pisu molekularra 10.000 baino handiago duten sustantzia organiko guztiak makromolekulatzat har daitezke. Makromolekulen artean polimeroak bereiztu behar dira; etengabe errepikatzen den unitateren bat dago haietan. Polimeroak naturalak izan daitezke (kautxu naturala, PHB (Poli (hidroxi butiratoa)), eta abar) edo sintetikoak (Poliestirenoa, Polibinilkloruroa, tefloia, eta abar).
Makromolekula biologikoak
Sistema biologikoetan makromolekulek erreakzio biokimikoetan parte hartzen dute. Elkarri lotzen diren unitate txikien katea luzeak dira makromolekulak. Unitate txiki horiek elkarren antza dute, baina ez dira, haatik, berdin-berdinak. Hori dela eta, makromolekula biologiko mota asko sor daitezke. Talde horretan bi multzo nagusi bereiz daitezke: azido nukleikoak (RNA eta DNA) eta proteinak (entzimak barne). Bai azido nukleikoak bai proteinak oinarrizko unitateez osaturik daude. Unitateen kopuruak, motak eta espazioan hartzen duten kokalekuak itxuratzen dituzte makromolekulen propietateak.
Proteinen kasuan oinarrizko unitateak aminoazidoak dira. Aminoazidoek amino talde bat
 eta azido
talde bat (-COOH) dituzte. Bi baldintza horiek betetzen dituzten 20 aminoazido ezagutzen dira izadian.
eta azido
talde bat (-COOH) dituzte. Bi baldintza horiek betetzen dituzten 20 aminoazido ezagutzen dira izadian.

Proteinek espazioan hartzen dute helize itxurako egitura.

Proteinetan parte hartzen duten aminoazido ezberdinak.
Hogei aminoazido horien artean milaka konbinazio gerta daitezkeenez, proteina desberdin ugari sor daiteke
(5 milioi inguru). Aminoazido baten COOH taldeak beste baten  taldearekin errakzionatzean, amida talde bat sortzen da. Lotura mota horri lotura peptidikoa esaten zaio.
Lotura horiek errepikatzearen errepikatzeaz sortzen da proteina. Oro har, proteina batean 100 aminoazido edo gehiago izaten dira.
Lotura peptidikoen arabera mugatzen da pr oteina baten aminoazidoen sekuentzia, eta horri proteinaren egitura primarioa esaten zaio.
Baina C=O eta N-H taldeen polartasunak haien artean hidrogenozko zubiak gertatzeko aukera eskaintzen du.
Hori dela eta, aminoazidoz osaturiko katea helize baten moduan kiribiltzen da, eta egitura hori hidrogenozko zubien bitartez egonkortzenda.
Egitura horri egitura sekundarioa esaten zaio. Proteinen egitura hiru dimentsiokoak proteinaren funtzio biologikoa muga dezake.
taldearekin errakzionatzean, amida talde bat sortzen da. Lotura mota horri lotura peptidikoa esaten zaio.
Lotura horiek errepikatzearen errepikatzeaz sortzen da proteina. Oro har, proteina batean 100 aminoazido edo gehiago izaten dira.
Lotura peptidikoen arabera mugatzen da pr oteina baten aminoazidoen sekuentzia, eta horri proteinaren egitura primarioa esaten zaio.
Baina C=O eta N-H taldeen polartasunak haien artean hidrogenozko zubiak gertatzeko aukera eskaintzen du.
Hori dela eta, aminoazidoz osaturiko katea helize baten moduan kiribiltzen da, eta egitura hori hidrogenozko zubien bitartez egonkortzenda.
Egitura horri egitura sekundarioa esaten zaio. Proteinen egitura hiru dimentsiokoak proteinaren funtzio biologikoa muga dezake.
Azido nukleikoetan, berriz, nukleotidoak dira oinarrizko unitateak.
Nukleotido bat osatzeko 5 karbonoko monosakarido bat (erribosa edo desoxirribosa),
fosfato talde bat  eta molekula organiko zikliko bat lotzen dira (molekula basiko bat: timina, zitosina, urazilo, guanina eta adenina).
eta molekula organiko zikliko bat lotzen dira (molekula basiko bat: timina, zitosina, urazilo, guanina eta adenina).
Unitate bateko azido fosforikoaren eta beste bateko monosakaridoaren artean nukleotidoak lotzen dira. Fosfato taldea eta monosakaridoa txandakatuz osaturiko ardatz nagusia izango da, beraz, katea, eta handik zintzilika izango dira base nitrogenatuak.

Nukleotido bat.
Proteinetan gertatzen zen bezalatsu, orain ere nukleotidoak elkarrekin lot daitezke hidrogenozko zubien bitartez. Hidrogenozko zubiak base nitrogenodunen artean gertatuko dira eta base horiek modu zehatz batean bakarrik konbina daitezke elkarrekin (adenina/timina, guanina/zitosina). Hidrogeno zubien bitartez nukleotidoz osaturiko bi ardatz nagusi lotzean, DNA (azido desoxirribonukleiko) lortzen da. DNA bi kateez osaturik dago eta espazioan helize baten itxura har - tzen du. Horixe da zeluletan agertzen den molekularik handiena. ARNaren kasuan nukleotidoen ardatz bakarra agertzen da.
DNA da informazio genetikoa gordetzeko arduraduna, eta RNAk, berriz, DNAan gordetako informazioa errepikatzeko ardura du, izaki bizidunaren proteinak sintetizatu ahal izateko.
Bi talde nagusi horiez gainera, aipagarriak dira ere polisakaridoak: almidoia edo zelulosa adibidez. Horietan monosakarido da (azukre molekula bat edo karbohidrato bat) errepikatzen den unitatea, eta hainbat modutara lot daiteke bat hurrengoarekin. Oro har, kate lineala dela esan daiteke, kateen artean gurutzaketak gerta badaitezke ere.
Nylonaren aurkikuntza
1926. urtearen bukaeran, Charles Stin, Dupont etxeko kimika saileko zuzendariak, oinarrizko ikerkuntza programa bat aurkeztu zion zuzendaritza batzordeari. Ikerkuntzaren atal bat, polimerizazioa lantzea zen. Stinek hainbat zientzilari deitu zuen lan horretarako. Zientzilari horietako bat Wallace Hume Carothers zen, artean Harvarden lanean ari zen kimikari bat. Garai hartan, 1928 inguruan, eztabaida asko zegoen polimerizazioaz sorturiko gorputzen egituraren inguruan. Ordu arte, gorputz horiek molekula txikien elkarketak zirela zioten gehienek. Hermann Staudinger kimikari alemaniarra (1881-1965) ordea, ez zen iritzi horretakoa, eta material horiek molekula erraldoiez edo makromolekulez osatuak zirela zioen. Wallace Carothersek ontzat hartu zuen Staudingerren hipotesia, eta hori horrela behar zuela frogatzeari ekin zion. Alkoholen eta azidoen arteko kondentsazioarekin hasi zen, baina lehen urratsak etanolarekin eta azido azetikoarekin eman zituen (bi erreaktiboak monofuntzionalak ziren, erreakzionatzeko puntu aktibo bakarra zegoen molekula bakoitzean). Haiekin ezinezkoa zen molekula txikietatik abiatuz (etanola eta azido azetikoa) molekula erraldoiak lortzea. Carothersek, baina, garbi ikusi zuen monomero difuntzionalak behar zirela makromolekulak lortzeko. Eta, hala, 1929. urtearen bukaeran, pisu molekular handiko (1.500-4.000) sustantziak sintetizatzea lortu zuen, azido dikarboxiliko eta dialkoholetatik abiatuz.

Hasieran pisu molekular handiena 6.000 ingurukoa izango zela zirudien. Izan ere, iritzi zabalduenaren arabera, katea zenbat eta luzeagoa izan, hainbat eta txikiagoa zen kateen muturreko talde funtzionalaren erreaktibotasuna. Carothersek eta haren lankide Julian Hillek 3 atomo karbonatoko glikol (dialkohol) batekin eta 16 atomo karbonatoko diazido batekin 3-16 poliesterra –hala deitu baitzioten– lortu zuten.
Produktu horren pisu molekularra izugarri handia zen, 12.000-tik gorakoa. Produktu horrek, gainera, zuntzak egiteko balio zuen. Baina Carothersek eta bere taldeak, poliesterren mundua alde batera utzi, eta poliamiden munduan murgildu ziren. Zergatik, ordea, aldaketa hori? Poliester horiek oso elastikoak ziren, baina 100 °C azpitik urtu egiten ziren, disolbagarriak ziren garbiketan erabiltzen ziren disolbatzaile askotan, eta urak erasan zituen. Ezin, beraz, poliester haiekin jantzirik egin. Orduan, diamina eta diazidoak erabiliz, poliamidekin hasi ziren lanean; poliamida horien fusio puntua dezente garaiagoa zen.

Poliamida horiei nylon deitu zieten. Erreaktiboen luzera n eta m zenbakiez adierazi zen (n, m+2). Hau da, nylon 5,10 delakoa, adibidez, 5 atomo karbonatoko diaminatik eta 10 atomo karbonatoko diazidotik lortua zen. Nylonak oso egokia zirudien zuntzak egiteko, baina monomero merkeagoak lortu ziren –hexametilen diamina eta azido adipikoa–, eta horietatik abiatuz nylon 6,6 lortu zen.

1938an, New York Herald Tribune egunkariak urtero antolatzen zuen «Gaur Egungo Arazoak» forumean, Charles Stinek nylonen aurkikuntzaren berri eman zuen. Honela deskribatu zituen: «Nylon hauek lortzeko lehengaiak oso arruntak baldin badira ere (ikatza, ura eta airea), poliamida horiez eginiko zuntzak altzairua bezain sendoak, armiarma sareren hariak bezain finak, eta edozein zuntz natural baino elastikoagoak eta distiretan ederragokoak dira.»
1939an nylonezko lehenengo galtzerdiak Dupont etxearen Wilmingtongo (Delaware, EB) lantegiko langileen artean saldu ziren. 1940ko maiatzaren 15erako nahikoa polimero sintetizatua zegoen eta salmentak Estatu Batuetako estatu guztiera zabaldu ziren. New York hirian, lau milioi nylonezko galtzerdi pare saldu omen ziren ordu pare batean.
Carothers, ordea, ez zen arrakasta horretan partaide izatera iritsi. Urte gutxi batzuk lehenago, 1937ko apirilaren 29an hain zuzen, bere lanari aurrerabidea ikusten ez ziolako depresioak jota, bere buruaz beste egin zuen Filadelfiako hotel batean, zianuro potasikoa hartuta.
Polimeroak
Makromolekula biologikoez gainera polimeroek ere (nahiz naturalak nahiz sintetikoak)
garrantzi handia dute gure eguneroko bizitzan. Polimeroa esaten dugunean unitate bat errepikatzeaz
lorturiko katea edo egitura erraldoia esan nahi da. Erreakzio kimiko egokiaren bidez polimeroa
emango duen erreaktiboari monomeroa esaten zaio, eta baldintza jakin bat behar du: monomeroaren
molekulan gutxienez bi puntu aktibo behar dira erreakzionatzeko gaitasuna dutenak. Polimero sintetikoen artean,
polimeroan errepikatzen den unitateari erreperatuz gero, bi talde nagusi bereizi ohi dira: gehikuntzazko
polimeroak eta kondentsaziozko polimeroak. Lehenengoen artean, monomerotik polimerora igarotzean,
ez da atomorik desagertzen, bakarrik loturaren bat aldatzen baizik; horien artean ezagunenak polimero binilikoak dira
 :
polietilenoa, poli (binil kloruroa), poliestirenoa, poli
(metil metakrilatoa), eta abar. Kondentsaziozko polimeroetan, berriz,
monomeroen arteko erreakzioa gertatzean atomo batzuk kateatik
desagertzen dira, molekula txikiren bat —ura, askotan—
askatuz bidenabar. Monomeroak difuntzionala izan beharko du.
Adibidez, poliamidak (nylon), poliesterrak (polietilentereftalato),
poliuretanoak, eta abar.
:
polietilenoa, poli (binil kloruroa), poliestirenoa, poli
(metil metakrilatoa), eta abar. Kondentsaziozko polimeroetan, berriz,
monomeroen arteko erreakzioa gertatzean atomo batzuk kateatik
desagertzen dira, molekula txikiren bat —ura, askotan—
askatuz bidenabar. Monomeroak difuntzionala izan beharko du.
Adibidez, poliamidak (nylon), poliesterrak (polietilentereftalato),
poliuretanoak, eta abar.
Monomero errepikatuen kateak elkarrekin lot daitezke (baldintza jakin batzuetan, noski), eta lerro itxurako egitura sare itxurako bihurtuko da. Polimeroaren propietateak haren egitura kimikoaren araberakoak eta orobat osatzen duten kateek espazioan duten banaketaren araberakoak dira; hau da, polimeroa lerro itxurakoa, adarkatua edo sareatua izan, haren propietateak zeharo aldatuko dira. Tenperaturaren aurrean duten erantzunaren arabera polimeroak termoplastikoak, termogogorgarriak eta termoegonkorrak izan daitezke. Termoplastikoetan, egitura gogor samarra izatetik biguinagoa izatera igarotzen da polimeroa berotzean (adibidez, ur botiletan erabiltzen den polietilenoa); termogogorgarrietan, berriz, beroak kateen arteko loturak eragiten dituenez, polimeroa gogortu egiten da. Polimero termoegonkorretan, aldiz, kateak sare egitura du, eta beroak ezin du polimeroa bigundu. Gehiegi berotzean lotura kimikoak apurtu egiten dira eta materiala degradatu egiten da.
Beste polimero mota bat kopolimeroak dira. Kopolimeroetan bi monomero erabiltzen dira katea osatzeko. Monomeroen arteko erreaktibotasunak mugatuko du nola sartzen diren bi monomeroak katean zehar: a) txandakatuz (aditu batzuen ustez horiek ez lirateke kopolimero deitu behar); b) ordena jakinik gabe (zorizko kopolimeroak); c) tarte handi batean monomero bat eta gero bestea (blokezko kopolimeroak); d) katea nagusian monomero bat eta handik zintzilik bestea (txertozko kopolimeroak).
Polimero sintetikoen artean era guztietako materialak lor daitezke: material elastikoak (kautxua), beira bezain gogorrak (polikarbonatoa), zuntzak (nylona), erresistentzia kimiko handiko materialak (tefloia, silikona), polimero zurrunak (PVC), isolatzaile termikoak (poliestireno hedatua, poliuretano bitsa), margotzeko pinturak (pintura akrilikoak, binilikoak, eta abar). Betiko material guztiak polimeroz ordezka daitezkeela esan daiteke.
Gaur egun zaila izango da polimero berririk, kopuru handitan, ekoiztea industrian, dagoeneko probatu baitira monomero gehienak. Nolanahi ere, arlo horretako kimikariek eta gainerako zientzilariek (fisikariak, ingeniari, …) etengabe dihardute propietate bereziko polimero berriak lortu nahian: ezagutzen diren polimeroak nahastuz, prozesatze metodoak aldatuz, komonomeroak erabiliz, eta abar. Polimeroen munduan garrantzi handia hartu duen beste atal bat material horien birziklatzea izan da. Zer egin egunero botatzen den hondakin pila horrekin guztiarekin? Bi irtenbide nagusi daude: alegia, batetik, erabilitako materiala jasotzea eta birziklatzea, eta, bestetik, izadian berez endeka edo degrada daitezkeen materialak lortzea (polimero biodegradagarriak).
Urearen aurkikuntza
Hasiera batean sustantziak hiru talde nagusitan banatu ziren. Nicolas Lémery kimikari eta fisikari frantsesak bere Cours de Chymie (1675) liburuan mineralak, animaliak eta landareak bereizi zituen. Lavoisier (1743-1794) kimikari eta fisikari frantsesak animalia eta landare gai guztietan karbonoa eta hidrogenoa agertzen zirela aurkitu zuen. Orduan, sailkapen berri bat egin zen, eta bi talde nagusi bereiztu ziren sustantzien artean: izaki bizidunetatik eratorritakoak, batetik, eta izaki bizidunetatik ez eratorritakoak, bestetik. 1807an Jöns Jacob Berzelius (1779-1848) kimikari suediarrak gai elkartu organiko (edo konposatu organiko) deitu zien lehenengoz izaki bizidunetatik eratorritako sustantzia horiei. Garai hartako kimikari gehienek, bestalde, bizi indar batean sinisten zuten, alegia, materian ez den bizi indar batek gidatzen zuela organismoen bizien jarduera, eta bizi indar horrek bereizten zituela gai organikoak gainerakoetatik. Sinesmen hori bat zetorren garai hartako filosofia dotrina batekin, bitalismoarekin, hain zuzen. Filosofia joera horren arabera, bakarrik izaki bizidunengan zegoen indar bereziren bat behar zen sustantzia organikoak sortzeko. Beste era batera esanda, sustantzia organikoak ezin ziren laboratorio batean sintetizatu, produktu ez-organikoetatik abiatuz. Bitalismo horren indarra ahulduz joan zen pixkana-pixkana sustantzia organikoen arteko erreakzioetan besteetan betetzen ziren lege berberak betetzen zirela ikusi zenean. Baina teoria edo sinesmen horren aurkako aurkikuntzarik garrantzitsuena 1828an gertatu zen: Friedrich Wöhler kimikari alemaniarrak (1800-1882) urea lortu zuen laboratorioan, zianato amonikotik abiatuz, gai elkartu ez-organiko batetik abiatuz, alegia. Wöhlerren asmoa ez zen urea lortzea, zianatoen tasunak aztertzea eta zianato amonikoa lortzea baizik. Berun zianatoa amonio hidroxidoarekin erreakzionaraziz, disoluzio bat lortu zuen, eta osagaiak bakartzeko disoluzioa lurruntzen jartzean, amonio zianatoa tautomerizatu egin zen, eta urea sortu zen:

Aurkikuntza horretan ez zuten den-denek sinesten, baina pixkana- pixkana, bitalismoa indarrak galtzen joan zen. Wöhlerren ikasle Hermann Kolbe-k (1818-1884) azido azetikoa sintetizatzea lortu zuen 1845ean, eta 1850-1860 hamarraldian Marcelin Berthelot kimikari frantsesak (1827-1907) hainbat gai elkartu organiko sintetizatu zuen: metanoa, azetilenoa, bentzenoa, etanola…
Aspirina
Betidanik saiatu da gizakia oinazea kentzeko sendabide edo sendagairen bat aurkitzen. Aspaldidanik ezaguna zen etanolak, opioak, kokainak edo marihuanak duten mina kentzeko ahalmena. Mina kentzeko balio duten gaiei analgesiko esaten zaie. XVIII. mendean sahatsaren enborretik lorturiko gai bat oso analgesiko ona zela ikusi zen, eta 1860an azido salizilikoa lortu zen gai horretatik.

Azido salizilikoak oso propietate onak zituela ikusi zen, bai mina kentzeko bai hanturei aurre egiteko. Eta azkenean, kimikariek azido salizilikoa sintetizatzea lortu zuten, fenolaren gatz sodikoa anhidrido karbonikoarekin batera berotuz:

Ordu ezkero azido salizilikoa erruz erabiltzen hasi ziren, baina badu arazo txiki bat: oso zapore mikatza du, eta aho eta eztarriko ehunetan zauritxoak eragin ditzake. Azido azetil salizilikoa (aspirina) ere oso eraginkorra zela ikusi zen, eta ez zituen azido salizilikoak dituen arazoak sortzen. 1899tik aurrera azido azetil salizilikoa kantitate handitan sintetizatzen hasi ziren eta oraindik ere horixe da mundu osoan gehien kontsumitzen den botika.

Aspirina, gainera, ez da analgesikoa bakarrik, sukarraren aurka ere oso eraginkorra da. Sor dezakeen arazo bakarra txegoste aparatuan odol isurtzeak eragitea da. Normalean ez du aparteko arazorik sortzen, baina zenbait kasutan oso arriskutsua izan liteke. Aspirinaren beste eraginetako bat odola gatzatzea eragoztea da, eta horregatik ez da ebakuntza egin berrietan edo hemorragia bat dagoenean erabili behar. Estatu Batuetan urtean 100 milioi dolar baino gehiago gastatzen dira aspirinetan, eta beste asko aspirina eta beste osagai batzuen arteko nahasteetan (kafeina…). Oraindik ere dagoen botika erabilienetako eta eraginkorrenetako bat dela esan daiteke
PVC
Kloroak eta etilenoak 1,2-dikloroetanoa eratzeko duten erreakzioa
Gai elkartu horiek lortu ondoren, etilenoa zuzenean kloratzen da edo oxikloratzen da, eta 1,2-dikloroetanoa (DCE) sortzen du. Bitarteko gai elkartu hori isurkari bat da eta giroko tenperaturan ez du kolorerik.
400-500°C tenperaturan pirolisi bat gertatzen da, eta azido klohidrikoa monomerotik bereizten da. Erreakzio horretan erreakzionatu ez duen dikloroetanoa ateratzen da, eta gai hori destilatu egin daiteke nahasketatik bakartu eta lehenengo aldian berriz erabiltzeko. Prozesu horren baitan, aldi horretatik aurrera, hondar organokloratuak dituzten zati alkaternatu arinak eta astunak sortzen dira.
Etilenoa oinarritzat harturik VCM sintetizatzea aldi berean eta modu jarraituan gertatzen diren hiru prozesuren konbinazioaren ondorioa izaten da: etilenoa zuzenean kloratzea, etilenoa oxikloratzea eta etileno dikloruroaren pirolisia. Prozesu horren aldi likidoa berotan eta hotzetan gerta daiteke, oso exotermikoa da, eta erreakziozko produktuen %99,8 EDC izaten dira. Oxiklorazioa 230°C-tik 315°C-ra bitartean gertatzen da, bai oxigenoa dagoenean eta bai eguratseko airea dagoenean, eta %96tik %98ra EDC sortzen du.
1,2-dikloroetanoen cracking egitea binilo kloruroaren monomeroa eratzeko
DCE destilatu egin behar da %99,5ko garbitasuna izan dezan, eta prozesu horretan zehar beste hidrokarburo kloratu batzuen zatiak sortzen dira: kloroetanoa, triklorometanoa eta 1,1,2-trikloroetanoa beste gai elkartu batzuen artean, dioxinak barne (240°Ctik 450°Cra bitartekoa dute eratzeko tenperaturarik egokiena). Gai kutsagarri gehienek 1,2-dikloroetanoarekin berriz zirkulatzen dute, eta, normalean, HCIn dagoen azetilenoak baizik ez ditu arazoak sortzen. Aldi honetan sortzen diren dioxina gehienak DCE zatiari eransten zaizkio, eta DCE zati hori arazten denean zati astunetan geldituko dira, nahiz zati txiki bat prozesu horretan eratzen den erreakzio urak eramatenduen, eta beste zati txikiago bat eguratsera botatzen diren hondakinei erantsiko zaion.
DCEtik VCMrako pirolisia 500-600°C tenperaturan gertatzen da, eta tenperatura horretan DCE binilo kloruroaren monomeroan (VCM) eta HCI-n zatitzen da, azkenean %98-99 monomero ateratzen dela. Azpiproduktuak ere sortzen dira: azetilenoa, bentzenoa, hidrokarburo kloratuak eta alkitranak. Prozesu horren balantzeari esker pirolisian eratu den klorhidrikoa oso-osorik lehengai gisa erabiltzen da DCE sortzeko. VCMren sintesia prozesu jarraitua eta itxia da, eta beraz ez dauka harremanik gizakiarekin. Azpiproduktuak etengabe destilatzen dira eta ontzi batera ponpatzen dira.
Binilo kloruroa etengabe ekoiztean oktodibenzofuranoak sortzen dira; dokumentazio handia dago horri buruz. Produkzio lantegietan ez da aztertzen gai hori zer kopurutan sortzen den, inongo legek ez baitu aztertu behar hori arautzen. Hala ere, dioxina eta furano kopuruak neurtu izan dira PVC ekoizten duten fabrika batzuetako jalkinetan. Adibidez, Greenpacek Tarragonako Aiscondel fabrika salatu zuen dioxinaz eta furanoz kutsatutako hondakinak, legea hautsirik, botatzen zituelako. Dioxina oktakloratu eta furano oktakloratu kopuru handiak neurtu ziren (48.000 ng/Kg edo ppt, pisu lehorrean) oxiklorazio prozesuaren hondakinak metatzen diren lurruntze biltegiko hondakinetan.
Binilo kloruroaren monomeroaren polimerizazioa
MCV oinarritzat hartzen duten hiru polimerizazio prozesu daude PVC ekoizteko: suspentsioan, masan eta emultsioan. Hiru prozesu horiek erro libre batek hasten duen polimerizazioa dute oinarri, eta monomeroak erreakzionatzeko duen modua dute bereizgarri. Prozesu mota bat edo bestea izateak eragina izaten du sortzen den PVCren ezaugarri fisikoetan, eta, beraz, PVC horren geroztikako erabileran. Suspentsio bidez eginiko polimerizazioa da garrantzitsuena. MVC uretan dago suspentsioan eta polimerizazioa 45-57°Ctan egiten da, peroxidoaren gisako hasiera emaile bat behar izaten duela. Emultsio bidez eginiko polimerizazioan emultsio eragile bat erabiltzen da monomeroa uretan zabal dadin. Masan eginiko polimerizazioan MCV garbia erabiltzen da; PVC ekoiztu ahala hauspeatzen da, ez baita monomeroan ia disolbatzen.
Suspentsio bidez eginiko polimerizazio prozesuetan emultsio bidezko prozesuetan baino askoz MCV gutxiago botatzen da airera, «stripping» teknologia eragin handikoari esker batez ere. Suspentsio eta emultsio prozesuetako hondakin urek (ur disoluzioekin egiten baitira) MCV kopuru handiak izaten dituzte (<1 mg/litro). PVC lehorrean hondakinezko MCV egongo da, eta aplikazio gehienetan 10 g/Tm PVC baino txikiagoa izango da.
Gehigarriak eranstea
Azken PVC produktua aleak edo zatikiak dira, baina dauden egoera findu gabe horretan ez dira baliagarriak, eta, beraz, zer tasun eman nahi zaizkion produktuari -malgutasuna, opakotasuna…-, orduan gai elkartu jakin batzuk erantsi behar zaizkio. Hauek dira gehigarri nagusiak: plastifikatzaileak, egonkortasuna ematen duten gaiak, pigmentuak, bio-hilgarriak, sua geroratzen duten gaiak, etab. Gehigarri horiek azken produktuaren %50 baino gehiago izan daitezke. Gehien erabiltzen diren gehigarriak, PVCzko erretxinetan batez ere, plastifikatzaileak eta egonkortasuna ematen duten gaiak dira.
Plastifikatzaileek petroliotik eratorritako gai asko hartzen dituzte, eta malgutasuna behar duten produktu guztietarako erabiltzen dira: hodiak, kable elektrikoak… Plastifikatzaile arruntena DEHP da (di-2etilhexil-ftalato), minbizi eragilea izan ote daitekeen susmoa sortzen du gai horrek. PVC garbiak sutan gogor irauten badu ere, kloro asko daukalako hain zuzen, plastifikatzaile horiek sutan irauteko gaitasun hori gutxitzen dute, eta, beraz, sua geroratzen duten gaiak erantsi behar izaten zaizkio azken PVCri. Hauek dira sua geroratzen duten gai arruntenak: gai elkartu organobromatuak (bifenilo polibromatuak),gai elkartu organokloratuak (parafina kloratuak), trikloroalkilfosfatoak (tris(2-kloroetila) fosfatoa, TCEP), fosfatoak (triarila eta alkilarifosfatoak), gai elkartu inorganikoak (aluminio trihidroxidoa, magnesio hidroxidoa, zink boratoa, antimonio trioxidoa, gatz metalikoak). Gai horietako askok arriskua dakarkiote ingurugiroari eta osasunari.
PVCri egonkortasuna ematen duten gaiak eransten zaizkio beroak edo argi ultramoreak sortzen duten hondamena gutxitzeko. Betidanik beruna eta kadmioa erabili izan dira. Bi metal astun horiek toxikoak eta iraunkorrak dira, eta PVCren hondakinak bideratzeko aldietako batean ingurugiroa kutsa dezakete. Zenbait aplikaziotan kaltzioa-zinka eta barioa-zinka gai elkartuak erabili izan dira PVCren ordezko gisa.
Kadmioa ez da sekula erabili izan elikagaiak ukitzen dituzten aplikazioetan edo jostailuetan. Kadmioa plastikoetan erabiltzea debekatuta dago Suedian, Dinamarkan eta Holandan. Horrez gainera, Europako Batasuneko arau-aholkuak -berriki aldatuak- hiru urtez luzatu du leihoetako profiletan eta teilatuetako mintzetan kadmioa erabiltzeko epea, industriak ordurako erabilera horietarako gai egokiago bat aurkituko duelakoan.
Frogatu izan da ur hodietatik banaketa sisteman barrena beruna jariatu izan dela, hodi horiek erabiltzen hasitakoan batez ere, handik aste betera edo bi astera berun kontzentrazioa jaitsi egiten baita. Itsasoaren Kutsadura Saihesteko Osloko eta Pariseko Bilkuretako Zientzia Batzordearen arabera, berunari egonkortasuna emateko gaia PVCrekin nahasten denean produktu bat eratzeko, produktu hori ez da ia jariatzen.




