Fisika-Kimika»Fisika - Kimika
Zinetika kimikoa
Sarrera
Nola uler daiteke giro tenperaturan hidrogenoa eta oxigenoa nahastuta egotea eta elkarrekin ez erreakzionatzea urteetan eta urteetan, gauza jakina bada, ura eratzeko erreakzioa berezkoa dela eta oso exotermikoa gainera?
Erreakzioen berezkotasuna aztertu denean ikertu den gauza bakarra erreakzioen norabidea izan da, hau da zein aldetara abiatuko den erreakzio kimiko bat erreakzioan parte hartzen duten gaiak elkartzean. Ez da ezer ikertu erreakzioen lastertasunaz, ordea; gerta daiteke erreakzio bat berezkoa izatea baina inoiz ez ikustea erreakzioa bera, oso poliki gertatzen delako, adibidez. Gerta daiteke erreakzio bat oso exotermikoa izatea baina oso astiro gertatzea zenbait baldintzatan. Hori gertatzen da, adibidez, ikatzaren errekuntzan. Errekuntza oso exotermikoa da baina ez da ia-ia erreakziorik gertatzen giro tenperaturan aireko oxigenoarekin. Erreakzio honen lastertasuna edo abiadura oso txikia dela esan ohi da.
Gehienetan lastertasun hori handitzea komeni izaten da, batez ere industrian erabili ohi diren erreakzioetan. Zenbaitetan, hala ere, alderantzizkoa izan daiteke interes handikoa, alegia, erreakzio bat lasterregia izanik, erreakzio hori moteltzea, txikiagoa egitea bere lastertasuna. Burdinaren eta beste zenbait metalen herdoiltzea izango litzateke horietako kasu bat, zenbat eta astiroago gertatu burdinaren herdoiltzea garrantzi handiagokoa baita industria mailan. Janariak ere zenbat eta astiroago usteldu, hobe; usteltze prozesua, kasu honetan ere, mantsotzea komeni da.
Lehian izan daitezkeen bi erreakzio daudenean, lasterren gertatzen dena izan ohi da substantzia gehiago ematen dituena. Alkohol etilikoa deshidratatzean esaterako, etilenoa edo eter etilikoa sor daitezke. Tenperatura garaietan (> 160°C) etilenoa lortzen da, batez ere, dagokion erreakzioaren lastertasuna handiagoa delako. Tenperatura apaletan, berriz, alderantziz gertatzen da, eter etilikoa sortzen da batez ere, tenperatura horietan bigarren erreakzioaren lastertasuna delako handiagoa.
Horregatik da hain garrantzitsua erreakzioak nola gertatzen diren jakitea eta erreakzioen lastertasunari zerk eragiten dion aztertzea. Zinetika kimikoa esaten zaio arazo hauek ikertzen dituen kimikaren alorrari.
Svante Arrhenius
Upsalatik gertu jaio zen (Suedia) 1859an; bere garaiko kimikari-fisikari bikainenetako bat izan zen. Arrheniusek esan zuen aurrenekoz, 1884an aldeztu zuen doktore tesian, NaCI bezalako gaiak ioi gisa egoten direla ur disoluzioan. Proposamen horrek iraultza handia zekarren, artean elektroia aurkitu gabe baitzegoen, eta kimikariek nekez uler baitzezaketen kloro eta sodio atomoek nola har zezaketen kargarik. Arrheniusi kosta egin zitzaion bere tesia defendatzea, eta gatz disoluzioek uretan duten nolakotasunari buruzko haren ideiak ez ziren onartzen hasi, harik eta 1890eko hamarraldian elektroia existitzen zelako frogak ugaritzen hasi ziren arte. Azkenik, 1903an, bere doktoretzan neke handiz onartu zitzaion tesi harengatik berarengatik Nobel Saria eman zioten. Beste aurkikuntza garrantzi handiko bat egin zuen kimikaren alorrean: erreakzio kimikoen aktibazio energia aurkitu zuen.
Erreakzio kimikoen lastertasuna
Erreakzio kimikoetan erreaktiboak produktu bihurtzen dira denbora pasatu ahala. Nola neur liteke eraldaketa horien lastertasuna? Erreakzio lastertasuna erabiltzen da lastertasun hori adierazteko.
Erreakzio lastertasunak denbora unitateko desagertzen den erreaktibo baten kantitatea besterik ez du adierazten edo, nahi bada, denbora unitate bakoitzeko eratzen den produktu baten kantitatea. Erreakzio baten lastertasuna edo abiadura, dena dela, ez da berdina erreakzioa hasi den unean edo denbora tarte bat, izan luzea ala motza, igaro ondoren. Zenbaitetan lastertasuna handiagoa egiten da erreakzioa gertatu ahala, baina txikiagoa ere egin daiteke lastertasun hori. Gertaera hori bat-bateko erreakzio lastertasunaren kontzeptuak hartzen du kontuan.
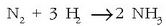 erreakzioaren kasuan, esaterako,
bistakoa da nitrogeno kantitatea geroago eta txikiagoa izango dela, hidrogenoarena ere txikiagoa egiten den
bezala edo amoniakoarena handitzen den bezala. Erreakzioari begiratuz,
erreakzioaren kasuan, esaterako,
bistakoa da nitrogeno kantitatea geroago eta txikiagoa izango dela, hidrogenoarena ere txikiagoa egiten den
bezala edo amoniakoarena handitzen den bezala. Erreakzioari begiratuz,
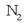 mol bakoitzeko 3 mol
mol bakoitzeko 3 mol
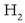 xahutzen dira eta 2 mol
xahutzen dira eta 2 mol
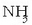 eratzen. Beraz, horren arabera,
hidrogenoaren desagertze lastertasuna nitrogenoaren desagertze lastertasunaren hirukoitza izango da, eta
amoniakoaren eratze lastertasunaren 3 / 2a. Erreakzio lastertasunak esanahi berdina eduki dezan,
behar-beharrezkoa da gai elkartuen koefiziente estekiometrikoa kontuan izatea. Hala bada,
honela definituko da amoniakoaren eraketa erreakzioaren abiadura:
eratzen. Beraz, horren arabera,
hidrogenoaren desagertze lastertasuna nitrogenoaren desagertze lastertasunaren hirukoitza izango da, eta
amoniakoaren eratze lastertasunaren 3 / 2a. Erreakzio lastertasunak esanahi berdina eduki dezan,
behar-beharrezkoa da gai elkartuen koefiziente estekiometrikoa kontuan izatea. Hala bada,
honela definituko da amoniakoaren eraketa erreakzioaren abiadura:
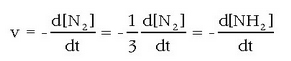
Oro har, nola erreakzio zuzenaren hasierako lastertasuna ikertu ohi den, erreakzioa honela idatz daiteke:
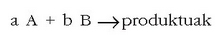
Erreaktibo bien kontzentrazioak, [A] eta [B], nahierara aldatuz, esperimentalki lastertasuna (v) eta kontzentrazioak erlazionatzen dituen adierazpen matematikoa lor daiteke; honi lastertasun ekuazioa esaten zaio edo lastertasunaren lege diferentziala, eta adierazpen matematiko hau dagokio:
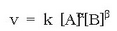
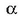 berretzaileari A erreaktiboarekiko erreakzio ordena esaten zaio.
berretzaileari A erreaktiboarekiko erreakzio ordena esaten zaio. 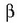 berretzailea, era berean, B erreaktiboarekiko erreakzio ordena da. Bien baturari ordena totala esaten zaio.
berretzailea, era berean, B erreaktiboarekiko erreakzio ordena da. Bien baturari ordena totala esaten zaio.
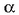 eta
eta
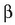 berretzaileek ez dute zertan izan,
eta hau oso garrantzitsua da, ekuazio estekiometrikoaren koefizienteen berdinak; ezta, halabeharrez, zenbaki osoak ere.
Esperimentu bidez bakarrik jakin daiteke ordena horien balioak zeintzuk diren.
berretzaileek ez dute zertan izan,
eta hau oso garrantzitsua da, ekuazio estekiometrikoaren koefizienteen berdinak; ezta, halabeharrez, zenbaki osoak ere.
Esperimentu bidez bakarrik jakin daiteke ordena horien balioak zeintzuk diren.
Lastertasun ekuazioan agertzen den k konstantea lastertasun konstante deritzona da, eta ez du balio bera err eakzio guztiei dagokienean, tenperaturaren arabera aldatzen bada ere, erreaktiboen kontzentrazioekin ez baita aldatzen. Lastertasun konstantearen unitateak desberdinak dira erreakzioaren ordena totala zein den.
A erreaktiboarekiko ordena lortzeko esperimentu bidez, B-ren kontzentrazio bera erabiliko da zenbait esperientzietan eta A-ren zenbait kontzentraziorentzat duen lastertasuna neurtuko da. Baldintza horietan erreakzio lastertasuna honela adieraziko da:
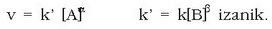
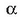 zenbaki osoa bada, bere balioa jakiteko datuei begiratu besterik
ez dago. Ikus adibidea.
zenbaki osoa bada, bere balioa jakiteko datuei begiratu besterik
ez dago. Ikus adibidea.
Honelako erreakzio kimiko batentzat:
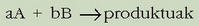
datu esperimental hauek lortu dira:

Datuei begiratu baino ez dago: A-ren kontzentrazioa bikoizterakoan, B-ren kontzentrazioa
konstante mantenduz (ikusi 1. eta 2. esperimentuak), erreakzio lastertasuna ere bikoiztu egiten da,
hau da, 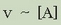 izango da.
[A] konstante mantenduz, ostera, B-ren kontzentrazioa bikoizterakoan, erreakzio lastertasuna lau aldiz handiagoa egiten da;
beraz
izango da.
[A] konstante mantenduz, ostera, B-ren kontzentrazioa bikoizterakoan, erreakzio lastertasuna lau aldiz handiagoa egiten da;
beraz 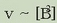 Dena kontuan harturik, lastertasun ekuazioa hauxe izango da:
Dena kontuan harturik, lastertasun ekuazioa hauxe izango da:
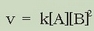
Ikertutako erreakzioa, beraz, lehen ordenakoa izango da A gaiarekiko eta bigarren ordenakoa B-rekiko. Ordena totala 3 izango da.
k-ren balioa ateratzeko lortu den adierazpenean edozein esperimentutako balioak ordezkatu besterik ez da egin behar. Ordezka ditzagun lehenengo esperimentuko datuak:
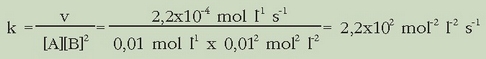
Erreakzio kimikoen teoria
Uraren eraketaren lastertasuna bere elementuetatik abiatuz ia-ia zero da giro tenperaturan
eta erreakzio oso exotermikoa da. Aldiz, uraren eraketarena, ostera, bere ioietatik abiatuz
 erreakzio
exotermikoa da baina ez aurrekoa beste, bat-batean gertatzen da. Nola uler liteke hori?
Molekulen artean zer gertatzen den jakin behar da fenomeno horiek ondo ulertzeko.
erreakzio
exotermikoa da baina ez aurrekoa beste, bat-batean gertatzen da. Nola uler liteke hori?
Molekulen artean zer gertatzen den jakin behar da fenomeno horiek ondo ulertzeko.
Erreakzio kimikoetan zenbait lotura hausten dira, erreaktiboenak, eta beste zenbait eratzen dira, produktuenak. Prozesu horiek gerta daitezen, erreakzionatuko duten gaiek elkarren kontra talka egin beharko dute. Hau da talken teoria izenekoa, gasen teoria zinetikoan oinarritua.
Baina gerta daiteke elkarren kontra talka egiten duten bi molekulak erreakziorik ez sortzea ere. Talka eraginkorra izan dadin, hau da, erreakzioa gerta dadin, bi baldintza hauek bete behar dira gutxienez:
1. Talka egiten duten molekulek nahikoa energia zinetikoa eduki behar dute, talkan zenbait lotura, behar direnak, apur edo, behinik behin, lasai daitezen. Talka honen ondorioz sortzen diren molekulei molekula aktibatu esaten zaie eta fenomenoa gerta dadin behar den energiari aktibazio energia.
2. Talkak orientazio egokian gertatu behar du. Molekulek nahikoa energia edukita gerta daiteke talka eraginkorra ez izatea, orientazio desegoki batean gertatu delako.
Hala gertatzen da, adibidez, ontzi itxi batean 280°C-tan eta 45 atmko presioan
gertatutako hidrogenoaren eta iodoaren arteko erreakzioan:
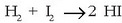 , nahastea zentimetro kubo batean,
ezaguna denez, hauexek dira gertatzen diren talkak:
, nahastea zentimetro kubo batean,
ezaguna denez, hauexek dira gertatzen diren talkak:

Horren arabera, 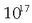 talkatik bat bakarra da eraginkorra.
talkatik bat bakarra da eraginkorra.
Talken teorian garrantzi handiko aldaketa bat sartu zen, trantsizio egoeraren teoria delakoa; trantsizio egoerak erreakzioa konplexu aktibatu baten bitartez (trantsizioko konplexua) gertatzen dela dio teoria horrek. Hau molekula erreakzionatzaileek eratutako konplexua da; bertan zenbait lotura apurtuta, edo lasaituta gutxienez, daude jadanik eta beste batzuk eratzen ari dira. Energia kantitate handia duenez (loturetan talka egin duten molekulen energia dauka pilatuta) oso ezegonkorra da eta erraz deskonposatzen da erreakzioaren produktuak emanez:
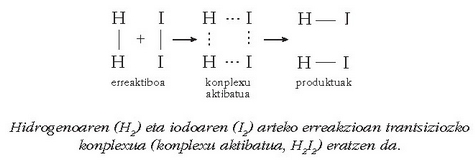
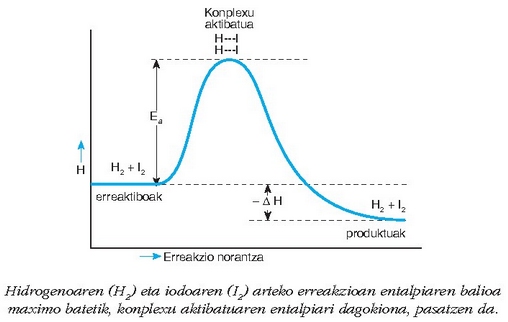
Konplexu aktibatua era dadin, gorago aipatutako baldintzak bete behar dira. Berau lortzeko behar den energia, erreaktiboen energia zinetikotik dator eta aktibazio energia esaten zaio; orientazioak ere, ikusi den bezala, egokia izan behar du konplexu aktibatua era dadin.
Konplexu aktibatua era dadin energia langa, aktibazio energiaren garaiera duena (Ea), gainditu behar du. Aktibazio energia apala bada, bistakoa da, molekula asko egongo dira langa gainditzeko adina energia zinetikorekin eta, ondorioz, molekula gehiago egongo dira,
eraginkortasunez talka egingo dutenak.
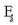 garaia bada, ostera,
molekula gutxik izango du nahikoa energia zinetiko eta gutxi izango
dira energia langaren gainetik igarotzeko gai.
garaia bada, ostera,
molekula gutxik izango du nahikoa energia zinetiko eta gutxi izango
dira energia langaren gainetik igarotzeko gai.
Erreakzio exotermikoa izanik ere, ondo ulertzen da zergatik beharko den zenbait kasutan molekulei energia ematea, energia langa gaindi dezaten; hori oso zaila da bestalde, aktibazio ener gia oso handia bada.
Erreakzio lastertasunean eragina duten faktoreak
Erreakzio baten lastertasuna desberdina da molekula erreaktiboen talka eraginkorren kopurua zein den, eta erreakzioa lasterrago gerta dadin nahi bada, handiagoa egin ote daiteke talka eraginkorren kopurua erreakzioa lasterragotzeko? Nola?
Talka eraginkorren kopurua ondoren ematen diren eragileen arabera alda daiteke:
1.- Talka kopuruaren arabera; erreaktiboen kontzentrazioaren eta beren egoera fisikoaren arabera aldatzen da.
2.- Talken eraginkortasuna. Nahikoa energia zinetiko duen molekula kopuruaren arabera aldatzen da eta hau, energia alegia, tenperaturarekin aldatzen da neurri batean.
3.- Aktibazio energia. Talkak eraginkorrak izan daitezen, molekulek eduki behar duten energia minimoa finkatzen du; ezberdina da konplexu aktibatuetan egitura zein den edo erreaktiboen izaera zein den. Katalizatzaileek ere zeresan handia dute aktibazio energiaren balioan.
Banan-banan aztertuko dira eragile guztiak.
a) Erreaktiboen izaera
Har ditzagun ondoko erreakzioen lastertasunak:
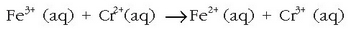 Oso erreakzio lasterra.
Oso erreakzio lasterra.
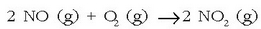 Tarteko lastertasuna.
Tarteko lastertasuna.
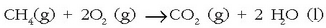 Oso erreakzio geldoa.
Oso erreakzio geldoa.
Zer dela eta horren diferentzia handia erreakzio horien artean?
Lehenengoan ez da ez loturarik apurtzen ez eratzen, elektroi trukea besterik ez da gertatzen ioien artean.
Bigarrenean O=O lotura hausten da eta beste bi eratzen dira.
Hirugarrenean, berriz, 6 lotura hausten dira eta beste 6 berri eratzen.
Adibide hauetan ikusten den bezala, esan daiteke, giro tenperaturan lastertasun handia izango dutela loturen birmoldaketarik ez dakarten erreakzioek. Horrela gertatzen da ioien arteko erreakzioetan gehienetan. Zenbait lotura hausten diren erreakzioak, berriz, geldoak izan ohi dira. Emandako araua ez da zehatz-zehatza baina erabilgarri izan daiteke.
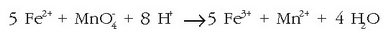
motako erreakzio bat oso konplexua da estekiometriari begiratzen bazaio, bertan lau lotura apurtzen baitira eta beste zortzi eratzen; gainera 14 ioik hartzen dute parte. Hala ere, esperimentalki ikusita, oso erreakzio lasterra da. Erreakzio konplexu hauek zenbait erreakzio sinple oso lasterren ondorio izan ohi dira.
b) Erreaktiboen kontzentrazioa eta egoera fisikoa
Talken teoriari jarraituz, behar-beharrezkoa da, erreakzioa gerta dadin,
molekulen artean talkak egotea. Baina teoria zinetikoaren arabera, talka kopurua
erreaktiboen kontzentrazioen proportzionala da. Beraz HI-aren eraketa erreakzioan
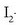 -aren
kontzentrazioa bikoiztu egiten bada, bikoizten ari da hidrogenoak edukiko duen talka kopurua
eta horrekin erreakzio lastertasuna bikoiztu da. Beste horrenbeste gertatuko litzateke,
-aren
kontzentrazioa bikoiztu egiten bada, bikoizten ari da hidrogenoak edukiko duen talka kopurua
eta horrekin erreakzio lastertasuna bikoiztu da. Beste horrenbeste gertatuko litzateke,
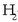 -aren
kontzentrazioa bikoiztuko balitz. Beraz erreakzio lastertasuna erreaktiboen
kontzentrazioen proportzionala izango da. Matematikoki:
-aren
kontzentrazioa bikoiztuko balitz. Beraz erreakzio lastertasuna erreaktiboen
kontzentrazioen proportzionala izango da. Matematikoki:
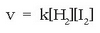
Erreakzio baten lastertasuna erreaktiboen kontzentrazioak ber koefiziente estekiometrikoaren proportzionala izan ohi da. Honi masa ekintzaren legea esaten zaio.
Erreaktibo bat soberan jartzeak izan dezakeen eragina.
Proportzio definituen legearen arabera, 1 mol 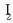 eta 2 mol
eta 2 mol 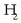 erreakzionaraztean,
2 mol HI eratuko dira eta ez gehiago. Hala er e erreakzioaren lastertasun handiagoa izango da, lortuko den
produktuaren kantitatea berdina izango bada ere.
erreakzionaraztean,
2 mol HI eratuko dira eta ez gehiago. Hala er e erreakzioaren lastertasun handiagoa izango da, lortuko den
produktuaren kantitatea berdina izango bada ere.
Erreakzio askotan ez da masa ekintzaren legea betetzen. Beteko balitz erraz lor liteke lastertasunaren ekuazioa ekuazio estekiometrikoetatik abiatuz, eta kasu horretan erreakzio ordenak bat etorriko lirateke koefiziente estekiometrikoekin. Baina askotan ez da horrelakorik gertatzen.
Masa ekintzaren legea oinarrizko erreakzioetan betetzen da bakarrik.
Hidrogeno bromuroaren oxidazioaren ekuazio estekiometrikoa hau da:
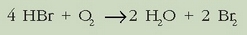
Eta lastertasun ekuazioa, berriz, esperimentalki lortuta hauxe da:
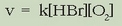
Ikusten den bezala ez da betetzen, beste askotan bezala, masa ekintzaren legea. Beteko balitz hau izango litzateke lastertasun ekuazioa:

Masa ekintzaren legea betetzen denetan ere, erabili ahal izateko beharrezkoa da erreaktibo guztiak fase berean egotea (gas fasean edo disoluzioan). Fase batean gertatzen diren erreakzioei homogeneo deritze. Heterogeneo esaten zaien erreakzioetan erreaktiboak fase ezberdinetan daude. Substantzia gotor batek isurkari edo
gas batekin erreakzionatzen duenean, adibidez. Erreakzio hauetan substantzia gotorraren gainazalean gertatzen da; erreakzioaren lastertasuna askoz handiagoa egingo da gainazala zenbat eta handiagoa izan. Erreakzioak zenbaitetan, substantzia solidoa birrin-birrin eginda dagoenean, hain azkar gertatzen dira, leherketak izan ohi baitira.
Erreakzioak azkar gerta daitezen baldintzarik egokienak gas egoeran edo disoluzioetan izaten ohi dira, orduantxe izaten da zatiketarik handiena.
c) Tenperaturaren eragina
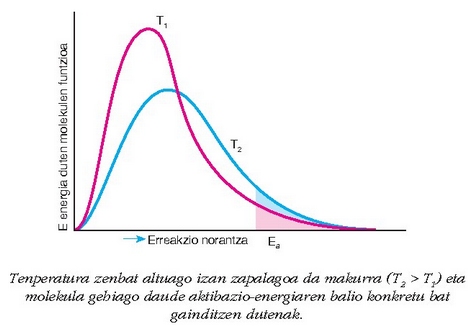
Edozein erreakzioren lastertasuna asko handitzen da tenperaturarekin. Nola uler daiteke tenperaturaen eragin hau?
Tenperatura igotzerakoan molekulen lastertasuna handiagoa egiten da eta horrekin batera, talka kopurua.
Teoria zinetikoaren arabera, ordea, tenperatura 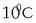 igotzerakoan, molekulen bataz besteko
lastertasuna %2 besterik ez da igotzen eta err eakzioaren lastertasuna
askoz gehiago igotzen da hori baino. Arrazoia, beraz, ez
da molekulen lastertasunean bakarrik aurkitu behar.
igotzerakoan, molekulen bataz besteko
lastertasuna %2 besterik ez da igotzen eta err eakzioaren lastertasuna
askoz gehiago igotzen da hori baino. Arrazoia, beraz, ez
da molekulen lastertasunean bakarrik aurkitu behar.
Nahikoa energia zinetiko, aktibazio energia baino handiagoa, duten molekulen portzentaia tenperatuaren eraginez igotzen da eta horrekin batera talka kopurua
d) Katalizatzaileak
Oso kantitate txikitan erabiltzen bada ere, bere izaera ezertarako ere aldatu gabe, erreakzioen lastertasunak asko aldatzen duten substantziak dira katalizatzaileak. Fenomenoari katalisia esaten zaio.
Katalizatzialeek erreakzio lastertasuna igotzearen arrazoia, zein da ordea?

Hasieran katalizatzaileek ez zutela erreakzioan parte hartzen uste izan zen. Gaurko egunean, ostera, katalizatzaileek parte hartzen dutela frogatuta dago: erreakzioan zehar tarteko gai elkartu ezegonkorrak eratzen dituzte, ondoren bat-batean deskonposatu eta katalizatzaile bera emango dute. Horretara katalizatzaileak erreakzioaren bidea aldatzen du, eta erreakzioa aktibazio energia apalagoko batetik gertatzen da.
Alderantzizko erreakzio lastertasunak ere aldatzen dituzte katalizatzaileek, baina ez dituzte inondik inora erreakzioen funtzio termodinamikoak, H eta G, aldatzen. Katalizatzailek, beraz, ez dute orekaren desplazamendua eragiten, beraien efektu bakarra oreka iristeko behar den denbora laburrago egitea da.
Katalizatzaileak dira, besteak beste, entzima izeneko substantziak, biokatalizatzaile ere deituak. Pisu molekular garaiko proteinak izan ohi dira eta izaki bizidunetan gertatzen diren erreakzio gehienak katalizatzen dituzte. Espezifikoak dira oso eta jarduera bizikoak; badira katalizatzaile artifizialak ere, baina ez dira haiek bezain eraginkorrak.
KATALISIA
Bi ontzi daude argazkian, xafla batek bereizita; goiko partean
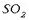 dago (gasa) eta behekoan
dago (gasa) eta behekoan 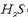 (hau ere gasa).
(hau ere gasa).

Gasak nahas daitezen bien arteko xafla kendu da baina ez da erreakziorik ikusten.

Ontzietan ur tanta batzuk sartu eta ontziei eraginez, sufre horia geratzen da ontzien paretetan itsatsita; gasen artean errakzioa gertatu da, urak katalizatzaile gisa jokatu duelarik. Urik gabe ez zen errakzioik gertatzen.






